
A.乙醇在浓![]() 存在下发生消去反应
存在下发生消去反应
B.乙醇与金属钠的反应
C.乙醇与氢卤酸的取代反应
D.乙醇的催化氧化反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:












查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
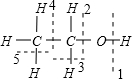 ,则乙醇完全燃烧时,可能不断裂的键是:
,则乙醇完全燃烧时,可能不断裂的键是: ②CH2=CH2 ③CH≡CH ④
②CH2=CH2 ③CH≡CH ④ ⑤
⑤
 ⑦
⑦ 中属于芳香烃的是
中属于芳香烃的是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 水浴 |
| 水浴 |
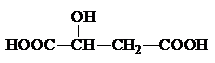 ,该分子中官能团的名称为
,该分子中官能团的名称为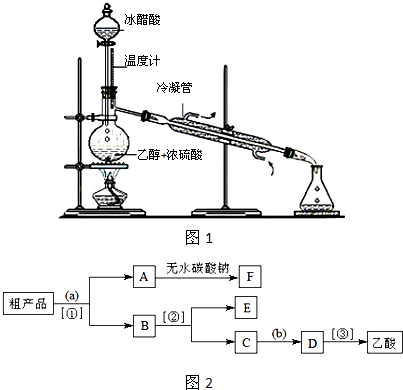
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| c3(H2O)×c(CH3CH2OH) |
| c2(CO2)×c6(H2) |
| c3(H2O)×c(CH3CH2OH) |
| c2(CO2)×c6(H2) |
| 温度/℃CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com