
电镀厂镀铜废水中含有CN-和Cr2O72- 离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理, 回答下列问题:
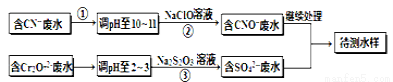
(1)上述处理废水流程中主要使用的方法是 。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于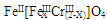 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是 。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是 。
A.x =0.5 ,a =8 B.x =0.5 ,a = 10 C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
(15分)(1)氧化还原法(3分) (2)CN-+ClO-=CNO-+Cl-(3分)
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O(3分)
(4)Cu2++2OH-=Cu(OH)2↓ Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq)
因为:KSP(CuS)<KSP[Cu(OH)2] (3分) (5)D(3分)
【解析】
试题分析:(1)处理废水流程中CN-→CNO-;Cr2O72-→Cr3+。因此使用的方法是氧化还原法。
(2)②中反应NaClO将CN-氧化,无气体放出,产物为CNO-,即:CN-+ClO-===CNO-+Cl-。
(3)步骤③中,反应是1mol Cr2O72-时转移电子6mol,即Cr2O72-→Cr3+,3S2O32-+4Cr2O72-+26H+=== 6SO42-+8Cr3++13H2O。
(4)取少量待测水样于试管中,加入NaOH溶液,生成蓝色沉淀Cu(OH)2,再加Na2S溶液,Cu(OH)2转化成黑色沉淀CuS(s),说明KSP(CuS)<KSP[Cu(OH)2]。
(5)设最终生成了y mol混合物。寻找关系:
Cr元素量不变,则有:(2-x)y=2
Fe元素量不变,则有:(1+x)y=a
Fe失去的电子量=Cr得到的电子量,则有:xy=2×(6-3)=6
得:X=1.5,y=4,a=10
考点:化学与技术的废水处理问题。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
关于如图所示各装置的叙述中,正确的是
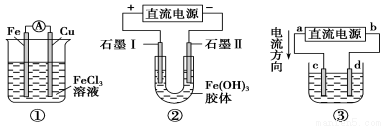
A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省益阳市高三下学期模拟考试理综化学试卷(解析版) 题型:选择题
莽草酸的结构简式如下图所示,可用来合成药物达菲,下列关于莽草酸的说法错误的是

A.分子式为C7H10O5
B.分子中含有两种官能团
C.既可发生加成又可发生取代反应
D.能够使酸性高锰酸钾溶液和溴水褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:填空题
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
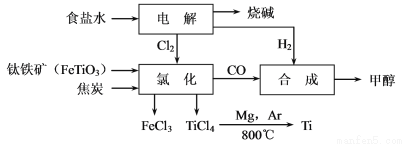
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 (5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
(5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
①已知该反应在300oC时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,上述产业链中每合成6 mol甲醇,至少需额外补充H2 mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:选择题
下列事实与结论(或推论)均正确的是
A.将氨水加到盛有AgCl固体的试管中,AgCl固体完全溶解,说明所得溶液中c(Ag+)·c(Cl-)>Ksp(AgCl)
B.物质的量之比为1: 2的Na2O2和NaHCO3的固体混合物,在密闭容器中充分加热反应后,残留的固体是Na2CO3
C.向FeBr2溶液中通入少量的氯气,再向反应后的溶液中滴加NaOH溶液,立即产生红褐色沉淀;那么向FeI2溶液中通入少量的氯气,也会出现同样的现象
D.将某混合气体通入品红溶液中,溶液不褪色,该气体中无Cl2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是
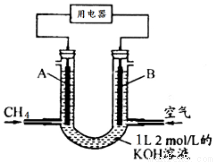
A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为: c(CO32- )>c(HCO3- )>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:填空题
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是 。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
(Ⅰ)原子半径:A < C < B < E < D
(Ⅱ)原子的最外层电子数:A = D, C = E, A+B = C。
(Ⅲ)原子的核外电子层数:B = C = 2A
(Ⅳ)B元素的主要化合价:最高正价+最低负价 = 2
(Ⅴ)F的单质或合金是用量最大的金属材料。
请回答:(1)甲由A、B两种元素按原子数之比为3:1组成的物质,写出其电子式 ;
(2)写出某含F黑色的磁性氧化物与B最高价氧化物对应水化物的稀溶液反应的离子方程式: 。
(3)由A、C、E三种元素组成的两种气体化合物,相互反应能生成淡黄色固体的化学反应方程式为: 。
(4)上述元素中A、B、C、E、F的五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 ;
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,该溶液中c(SO42-)为: (已知:忽略溶液体积变化。该沉淀的Ksp=2×10-9)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com