
| A. | 晶体中阳离子和阴离子数不一定相等 | |
| B. | 晶体中一定只有离子键没有共价键 | |
| C. | 所含元素一定不在同一周期也不在第1周期 | |
| D. | 晶体中阳离子半径一定大于阴离子半径 |
分析 由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20,且阴、阳离子所带电荷相等,则阴、阳离子均是10电子微粒,阴离子有:N3-、O2-、F-、OH-等,阳离子有:NH4+、Na+、Mg2+、Al3+等,以此解答该题.
解答 解:由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20,且阴、阳离子所带电荷相等,则阴、阳离子均是10电子微粒,阴离子有:N3-、O2-、F-、OH-等,阳离子有:NH4+、Na+、Mg2+、Al3+等.
A.当阴、阳离子所电荷不相等,阳离子和阴离子个数不相等,如、MgF2、Na2O,当阴、阳离子所电荷相等,阳离子和阴离子个数相等,如NaF、NaOH,故A正确;
B.X是离子化合物,一定有离子键,也可能含共价键,如NaOH、Mg(OH)2、NH4F等,故B错误;
C.NH4+中氢元素在第一周期,所以构成该离子化合物的元素可能在第一周期,故C错误;
D.对简单的离子,阴、阳离子电子层结构相同,核电荷数越大,离子半径越小,阳离子的核电荷数一定大于阴离子的核电荷数,所以X中阳离子半径小于阴离子半径,故D错误.
故选A.
点评 本题考查离子结构、物质结构等知识,侧重于学生的分析能力的考查,难度中等,本题采取列举法解答,找出例外举例,列举法在元素周期表中经常利用.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
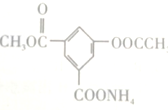 ,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
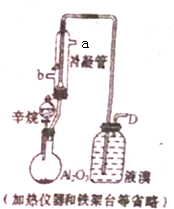 现以C8H18为原理经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,
现以C8H18为原理经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{8.5}{\sqrt{1.8}}$×10-12mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥⑧ | B. | ③⑥⑧⑨⑩ | C. | ②③⑤⑥⑦ | D. | ④⑤⑥⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
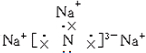 ;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.
;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3molH-H键断裂,同时2molN-H键断裂 | |
| C. | n(N2):n(H2):(NH3)=1:3:2 | |
| D. | 反应混合物的压强不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7g羟基含有的电子数目为NA | |
| B. | 常温常压下,23g由NO2与N2O4组成的混合气体含有的氮原子数目为0.5NA | |
| C. | 标准状况下,6.72L H2O中含有的水分子数目为0.3NA | |
| D. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
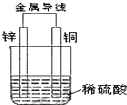
| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量不断减少 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 氢离子在铜片表面被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com