
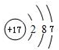
 ,写出化合物E2B2的电子式
,写出化合物E2B2的电子式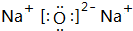 ,C在周期表中的位置第三周期VIA族.
,C在周期表中的位置第三周期VIA族.分析 A、B、C、D、E为周期表中1-20号元素中的主族元素,它们的核电荷数依次增大,B的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素,B、C同主族,则C为S元素;由于只有E为金属元素,A、E元素原子的最外层只有一个电子,则A为H元素,E为K;结合原子序数可知D为Cl.
解答 解:A、B、C、D、E为周期表中1-20号元素中的主族元素,它们的核电荷数依次增大,B的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素,B、C同主族,则C为S元素;由于只有E为金属元素,A、E元素原子的最外层只有一个电子,则A为H元素,E为K;结合原子序数可知D为Cl.
(1)A为氢,B为氧,E为钾,故答案为:氢;氧;钾;
(2)D为Cl,原子结构示意图为 化合物Na2O2的电子式为
化合物Na2O2的电子式为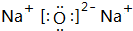 ,C为S元素,在周期表中的位置:第三周期VIA族,
,C为S元素,在周期表中的位置:第三周期VIA族,
故答案为: ;
;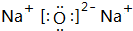 ;第三周期VIA族;
;第三周期VIA族;
(3)D和E的简单离子分别为Cl-、K+,二者电子层结构相同,核电荷数越大离子半径越小,故离子半径:Cl->K+,B和C氢化物分别为H2O、H2S,由于H2O分子之间形成氢键,故沸点H2O>H2S,
故答案为:Cl->K+;H2O>H2S;H2O分子之间形成氢键;
(4)C的最高价氧化物为SO3,E的最高价氧化物的水化物为KOH,二者反应生成正盐的化学方程式为:SO3+2KOH=K2SO4+H2O,
故答案为:SO3+2KOH=K2SO4+H2O;
(5)都由H、O、S、K四种元素组成的两种化合物之间反应的离子方程式:HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O.
点评 本题考查结构性质位置关系应用,明确元素种类是解答的关键,注意对基础知识的理解掌握.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| 化 学 键 | C-H | O-O | O=O | C-O | C=O | H-O |
| 能量 (kJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800 kJ | B. | 放出热量1520 kJ | C. | 吸收热量110 kJ | D. | 放出热量610 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO | |
| B. | 硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | |
| C. | 已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H=-283.0 kJ/mol C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | |
| D. | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3 | B. | 1H、2H+ | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | H、D、T |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
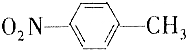 和
和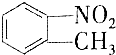 的一些物理性质如下表所示:
的一些物理性质如下表所示:| 物质 | 熔点 | 沸点 | 密度 | 水溶性 |
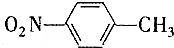 | -10℃ | 212℃ | 1.1622g/cm3 | 不溶于水 |
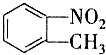 | 54℃ | 238℃ | 1.1581g/cm3 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
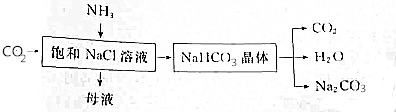
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
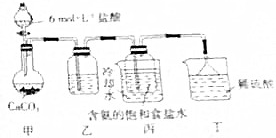
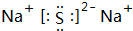 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氧化物 | 酸 | 碱 | 盐 | |
| A | Fe3O4 | CH3COOH | NH3•H2O | (NH4)2SO 4 |
| B | SO2 | H2SO4 | NaOH | Na2O2 |
| C | CO | HNO3 | Cu2(OH)2CO3 | FeSO4 |
| D | H2O | NaHSO4 | Ba(OH)2 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com