
分析 反应Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O中,Cu元素的化合价升高,则Cu为还原剂,N元素的化合价降低,则硝酸为氧化剂,生成NO2为还原产物,以此解答该题.
解答 解:(1)反应Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O中,Cu元素的化合价升高,则Cu为还原剂,N元素的化合价降低,则硝酸为氧化剂,生成NO2为还原产物,4HNO3参与反应被氧化和未被氧化的硝酸物质的量之比等于(4-2):2=1:1,故答案为:Cu;NO2;1:1;
(2)N元素化合价由+5价降低到+4价,硝酸表现为氧化性,同时生成硝酸铜,硝酸还表现为酸性,故答案为:氧化性;酸性;
(3)N元素化合价由+5价降低到+4价,所以当生成标况11.2LNO2时,反应中转移电子数是$\frac{11.2}{22.4}$mol×(5-4)=0.5mol,故答案为:0.5.
点评 本题考查氧化还原反应及氧化还原反应中转移电子数等计算,明确氧化还原反应中的基本概念及元素的化合价变化即可解答,题目难度不大..


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
| B | 制备Fe(OH)3胶体 | 烧杯、玻璃棒 | 饱和Na2CO3溶液、0.5mol/L FeCl3溶液 |
| C | 实验室制取NH3 | 试管、带导管的橡皮塞 | 浓氨水、生石灰 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、 0.100 0 mol/L盐酸、酚酞溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Al溶于稀硝酸中:2Al+6H+═2Al3++3H2↑ | |
| B. | CuH在足量C12中燃烧:2CuH+2Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+H2 | |
| C. | 向复盐NH4Al(S04)2溶液中加入Ba(0H)2至沉淀质量最大:NH4++Al3++4OH-+2SO42-═NH3•H2O+Al(OH)3↓+2BaSO4↓ | |
| D. | 向饱和NaHSO3溶液中加入FeC13溶液:S032-+2Fe3++H20═S042-+2Fe2++2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.  ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
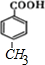 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
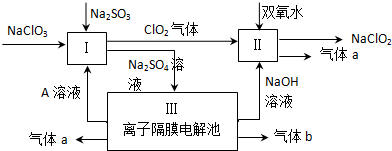
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com