
| A. | 铁能被磁体吸引,纯铁易生锈 | |
| B. | FeCl2可以通过铁与氯气的化合反应得到 | |
| C. | 缺铁性贫血里的铁是指铁元素 | |
| D. | 工业上常用铁矿石与氢气在高炉内反应来炼铁 |
分析 A.纯铁不易生锈;
B.Fe与氯气反应生成氯化铁;
C.血液中的铁不能以单质、原子形式存在;
D.从经济成本上利用焦炭作还原剂.
解答 解:A.纯铁不易生锈,钢铁易生锈,铁能被磁体吸引,故A错误;
B.Fe与氯气反应生成氯化铁,FeCl2可以通过铁与氯化铁的化合反应得到,故B错误;
C.血液中的铁不能以单质、原子形式存在,则缺铁性贫血里的铁是指铁元素,故C正确;
D.从经济成本上利用焦炭作还原剂,则工业上常用铁矿石与焦炭在高炉内反应来炼铁,故D错误;
故选C.
点评 本题考查铁的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实与训练,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | W的简单气态氰化物比Y的稳定 | |
| B. | XZ2与QY2中含有j的化学键类型相同 | |
| C. | 元素Q、Y的单质均只存在两种同素异形体 | |
| D. | Y的最高价氧化物对应水化物的酸性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
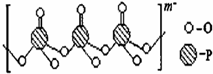 磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(
磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(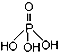 ),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:
),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO₃2-):,n(HSO₃-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.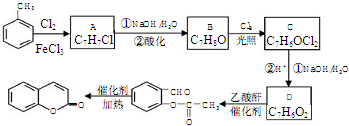
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应. )反应,除生成
)反应,除生成 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH. 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com