
| A、若5.6 LN2中含有n个氮分子,则阿伏加德罗常数一定为4n |
| B、4.6 g Na与100 mL含0.1 mol HC1的盐酸溶液反应,转移电子数目为0.1NA |
| C、14 g乙烯和丙烯的混合气体中所含原子总数为3NA |
| D、标准状况下,22.4 L CCl4含有的分子总数为NA |
| m |
| M |
| m |
| M |
| m |
| M |
| 4.6g |
| 23g/mol |
| m |
| M |
| 14g |
| 14g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、消除硫酸厂尾气中的SO2:SO2+2NH3+H2O═(NH4)2SO3 | ||||
| B、消除制硝酸工业尾气的氮氧化物:NO2+NO+2NaOH═2NaNO2+H2O | ||||
C、制CuSO4:Cu+2H2SO4(浓)
| ||||
D、制CuSO4:2Cu+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都有H2O生成 |
| B、反应后铝元素主要以AlO2-的形式存在 |
| C、都有H2生成 |
| D、反应后铝元素主要以Al3+的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B与E可以形成EB2型化合物 |
| B、A与E形成的化合物是离子化合物 |
| C、原子最外层电子数:B<A |
| D、最高价氧化物对应的水化物碱性:C<D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1摩 | B、1.5摩 |
| C、2摩 | D、3摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤素单质与水反应均可用X2+H2O═HXO+HX表示 |
| B、HX都极易溶于水,它们的热稳定性随核电荷数增大而增强 |
| C、卤素单质从F2→I2颜色逐渐加深 |
| D、X-的还原性依次为F-<Cl-<Br-<I-,因此排在前面的卤素单质可将排在后面的卤素从它的盐溶液里置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
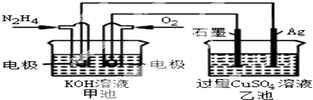
| A、反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 |
| B、甲池中负极反应为:N2H4-4e-═N2+4H+ |
| C、甲池溶液pH不变,乙池溶液pH减小 |
| D、甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com