
| A. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 己知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则水电离的热化学方程式为:H2O(l)?H+ (aq)+OH-(aq)△H=+57.3 kJ•mol-1 | |
| D. | 向0.1mol/L的CH3COONa溶液中加入少量醋酸钠固体,c(CH3COO-)/c(Na+ )变大 |
分析 A.反应的△S>0,室温下不能自发进行,可知△H-T△S>0;
B.先用饱和Na2CO3溶液浸泡,生成碳酸钙,且碳酸钙与盐酸反应;
C.中和反应的实质为氢离子与氢氧根离子反应生成水,互为逆反应时,焓变数值相同、符号相反;
D.加入少量CH3COONa固体,由电离出c(CH3COO-)增大,水解程度减小.
解答 解:A.反应的△S>0,室温下不能自发进行,可知△H-T△S>0,则说明该反应的△H>0,故A错误;
B.先用饱和Na2CO3溶液浸泡,生成碳酸钙,且碳酸钙与盐酸反应,则可处理锅炉水垢中的CaSO4,故B正确;
C.中和反应的实质为氢离子与氢氧根离子反应生成水,互为逆反应时,焓变数值相同、符号相反,由中和热可知水电离的热化学方程式为:H2O(l)?H+ (aq)+OH-(aq)△H=+57.3 kJ•mol-1,故C正确;
D.加入少量CH3COONa固体,由电离出c(CH3COO-)增大,水解程度减小,则c(CH3COO-)/c(Na+ )变大,故D正确;
故选A.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握反应进行的方向、盐类水解、中和热等为解答关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH(OH)COOH | C. | CH3CH2CH3 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
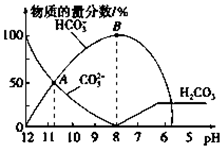 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| C. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| D. | 在0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-c}{a}$ | B. | $\frac{2b-c}{2a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,每生成1mol SO42-,可脱去2mol Cl2 | |
| B. | 该反应中氧化剂是Cl2,反应消耗的氧化剂与还原剂之比为4:1 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | SO2也有漂白性,将SO2与氯气混合后使用,漂白性会增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的降雨是酸雨 | |
| B. | 氯气泄漏后应顺风向低处跑 | |
| C. | SO2和HClO都具有漂白性,两者的漂白原理相同 | |
| D. | 我国城市环境中的大气污染物主要有SO2、NO2、可吸入颗粒物等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有水解 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4, 振荡,静置 | 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | T | |
| L |
| A. | 原子半径:X<Y<Z<T<L | |
| B. | 气态氢化物的还原性:L>Z>T | |
| C. | 含x的两种盐溶液混合可能生成沉淀 | |
| D. | Y的含氧酸的酸性小于T的含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
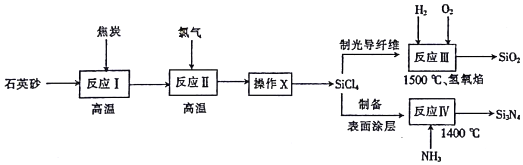
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com