
分析 甲厂的废水明显呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl--、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,由此可知:甲厂含有K+、Cl-、OH-,乙厂含有Ag+、Fe3+、NO3-,以此来解答.
解答 解:甲厂的废水明显呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl--、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,由此可知:甲厂含有K+、Cl-、OH-,乙厂含有Ag+、Fe3+、NO3-,两厂排出废水的流量使之混合,将大部分污染性强的离子沉淀而除去,发生的离子反应为Ag++Cl-=AgCl↓、Fe3++3OH-=Fe(OH)3↓,
故答案为:OH-、Cl-、K+;Ag+、Fe3+、NO3-;Ag++Cl-=AgCl↓、Fe3++3OH-=Fe(OH)3↓.
点评 本题考查离子的共存,为高频考点,把握甲厂的废水呈明显碱性及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 30min时减小容积 | |
| B. | 40min时加入催化剂 | |
| C. | 0~20min内A的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
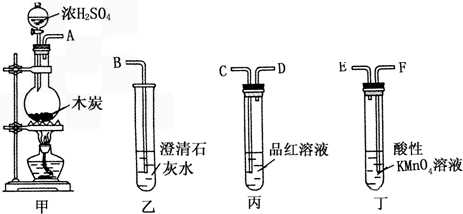
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离工业废水,回收废液中的有用成分 | |
| B. | 将化学能转换成电能,将热能转换成电能 | |
| C. | 食品工业中,浓缩天然果汁、乳制品加工和酿酒 | |
| D. | 海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
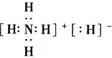 ,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com