
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
分析 A.四种物质在溶液中不反应,可以大量共存;
B.硫酸与氯化钡、氢氧化钠发生反应,硫酸钠与氯化钡反应;
C.硝酸银与氯化镁、盐酸均反应生成白色沉淀氯化银;
D.碳酸氢铵与氢氧化钠、盐酸反应,氢氧化钠与盐酸反应.
解答 解:A.Na2SO4、KNO3、Na2CO3、NH4Cl之间在溶液中不反应,可以大量共存,故A正确;
B.H2SO4与Na2SO4、NaOH均反应,BaCl2也和H2SO4反应,不能大量共存,故B错误;
C.AgNO3与MgCl2、HCl均反应生成白色沉淀氯化银,不能大量共存,故C错误;
D.NH4HCO3与NaOH、HCl均反应,NaOH和HCl也反应,不能大量共存,故D错误;
故选A.
点评 本题考查了离子反应及其应用,题目难度中等,明确离子反应发生条件为解答关键,试题侧重考查复分解反应的应用,有利于培养学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
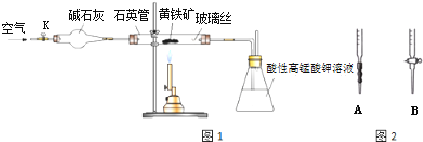
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验目的 | 实验操作 | |
| A | 鉴别Al3+和Fe3+ | 分别加入少量NaOH溶液 |
| B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
| C | 证明品红溶液褪色的原因是通入了SO2 | 将褪色后的溶液再加热 |
| D | 分离乙酸乙酯和乙酸 | 加饱和NaOH溶液,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C═C | C-C | C≡C | C-H |
| E/(kJ•mol-1) | 436.0 | 615 | 347.7 | 812 | 413.4 |

 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
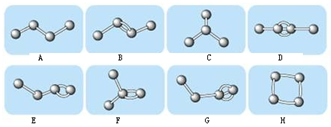
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
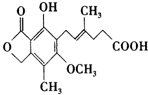 ,下列有关麦考酚酸说法不正确的是( )
,下列有关麦考酚酸说法不正确的是( )| A. | 分子式为C17H20O6 | |
| B. | 能与FeCl3溶液显色,与浓溴水反应,最多消耗量1 mol Br2 | |
| C. | 1mol麦考酚酸最多与3 mol NaOH反应 | |
| D. | 在一定条件下可发生加成,加聚,取代,消去四种反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 滴定达到终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 随着NaOH溶液的滴入,锥形瓶中的pH由小变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com