
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 次氯酸钠具有碱性,可用于配制“84”消毒液 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物 |
分析 A.液氨汽化时吸收热量;
B.次氯酸钠具有强氧化性、碱性;
C.氧化铝能和氢氧化钠反应生成偏铝酸钠和水;
D.二氧化硅和HF反应生成四氟化硅和水.
解答 解:A.液氨汽化时吸收热量导致其周围温度降低,所以液氨可以作制冷剂,故A正确;
B.次氯酸钠具有强氧化性、碱性,“84”消毒液是利用其强氧化性来杀菌消毒,所以用次氯酸钠配制“84”消毒液是利用次氯酸钠的强氧化性,故B错误;
C.氧化铝能和氢氧化钠反应生成偏铝酸钠和水,所以不能用氧化铝坩埚熔融氢氧化钠,应该用铁坩埚,故C错误;
D.二氧化硅和HF反应生成四氟化硅和水,生成的不是盐和水,所以二氧化硅不是两性氧化物,属于酸性氧化物,故D错误;
故选A.
点评 本题考查元素化合物性质,为高频考点,明确元素化合物性质、基本概念是解本题关键,侧重考查学生分析判断能力,易错选项是D,注意二氧化硅和HF反应产物成分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SiO2通常用于通讯行业 | |
| B. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 | |
| C. | 明矾可用作净水剂 | |
| D. | 金属钠可用于冶炼钛等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶中注入液体时,奖容量瓶的玻璃塞倒置在桌面上防止被污染 | |
| B. | 鉴别NO2和溴蒸汽时,将二者分别通到湿润的KI-淀粉试纸上观察颜色变化 | |
| C. | 将甲烷和乙烯的混合气体通入足量溴水,以除去乙烯 | |
| D. | 将洗净的滴定管放到烘箱中烘干,以加快干燥速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
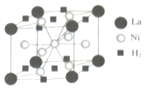 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: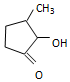 可形成配合物.
可形成配合物. 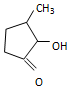 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl3-+Cl- | |
| B. | 充电时,泡沫石墨极与外电源的负极相连 | |
| C. | 放电时,电路中每流过3mol电子,正极减少27g | |
| D. | 充电时,阴极发生:4Al2Cl3-+3e-=Al+7AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
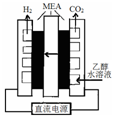 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:
氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁四种元素均为短周期元素 | |
| B. | 元素丁形成的化合物比元素乙形成的化合物少 | |
| C. | 气态氢化物的稳定性比较:甲>乙 | |
| D. | 最高价氧化物对应水化物的酸性比较:甲<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液与过量NaOH溶液反应 NH4++OH-=NH3↑+H2O | |
| B. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-=BaSO3↓+SO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com