
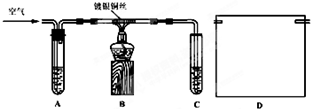
| Cu |
| △ |
| Cu |
| △ |
 ,
, ;
;

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、取适量滤液,向其中加入H2O2溶液,再加入淀粉溶液,观察 |
| B、取适量滤液,加入CCl4,振荡、静置,观察 |
| C、取适量滤液,蒸干,观察 |
| D、取适量滤液,加入酸化的H2O2溶液,再加入淀粉溶液,观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgNO3 |
| B、NaCl |
| C、CuCl2 |
| D、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
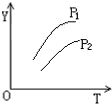 对于密闭容器中的可逆反应:4L(g)?2M(g)+N(g)△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示.图中y轴是指( )
对于密闭容器中的可逆反应:4L(g)?2M(g)+N(g)△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示.图中y轴是指( )| A、气体混合物的平均相对分子质量 |
| B、气体混合物的总物质的量浓度 |
| C、L在气体混合物的体积分数 |
| D、气体混合物的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,某密闭容器中存在可逆反应:X?Y+Z,其化学反应速率随时间变化的图象如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是( )
一定温度下,某密闭容器中存在可逆反应:X?Y+Z,其化学反应速率随时间变化的图象如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是( )| A、X在该条件下一定不为气体 |
| B、由t1~t3,平衡并未发生移动 |
| C、Y和Z在该条件下至少有一种为气体 |
| D、t1时刻达到平衡时和t3时刻平衡时,气态物质的浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮气是空气中含量最多的一种气体,氮气及其化合物在工农业生产、生活中有着广泛的应用.请回答下列问题:
氮气是空气中含量最多的一种气体,氮气及其化合物在工农业生产、生活中有着广泛的应用.请回答下列问题:| T(K) | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
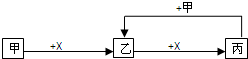 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )| A、若甲为单质铁,则丙一定为FeCl3 |
| B、若甲为强碱,则X一定为CO2 |
| C、若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+ |
| D、若甲为单质,则此关系中涉及的反应一定都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
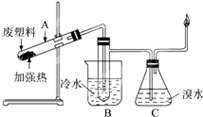 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如下表
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如下表| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
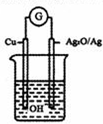 普通水泥在固化过程中自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法正确的是( )| A、铜电极附近有黑色沉淀生成 |
| B、负极的电极反应式为2Cu+2OH--2e-═Cu2O+H2O |
| C、测量原理示意图中,电流方向从Cu经过导线流向Ag2O |
| D、电池工作时,溶液中OH-向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com