
【题目】在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法不正确的是( )
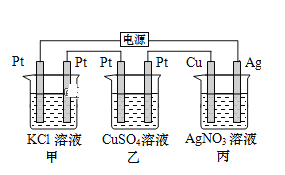
A.标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6g
B.电解过程中丙中溶液pH无变化
C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态
D.乙中左侧电极反应式:Cu2++2e-=Cu
【答案】C
【解析】
通电片刻即发现乙装置左侧电极表面出现红色固体,则表明此电极中Cu2+获得电子生成铜,附着在电极表面,所以此电极为阴极。因为三个电池串联,所以各电池中左边电极都为阴极,右边电极都为阳极。
A. 甲装置为电解KCl的装置,阳极生成氯气,阴极生成氢气,标准状况下当甲中产生4.48L气体时,线路中转移电子0.2mol。丙中线路上转移电子也为0.2mol,Cu电极上析出0.2molAg,质量增加21.6g,正确 ;
B. 丙装置为电镀装置,电解后,AgNO3溶液的组成和浓度不变,电解过程中丙中溶液pH无变化,正确;
C. 甲中电解后,有一部分KCl转化为KOH,向甲中加入适量的盐酸,可使KOH转化为KCl,但溶液中的溶剂量增加,溶液浓度减小,不可能恢复到电解前的状态,错误;
D. 乙中左侧电极为阴极,电极反应式:Cu2++2e-=Cu,正确。
故答案为C。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是
A. 0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C. H2(g)+![]() O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
D. CO(g)的燃烧热是283.0 kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CO2及氮氧化物的研究有更大意义:
(1)CO2与H2可用来合成可再生能源甲醇,已知CH3OH(l)标准燃烧热△H=-726.5kJ/mol、H2的燃烧热数值为285.8kJ/mol,则CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=___。
CH3OH(l)+H2O(l) △H=___。
(2)用NH3催化还原NOx时包含以下反应。
反应I:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H1<0
5N2(g)+6H2O(l) △H1<0
反应Ⅱ:4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g) + 6H2O(l) △H2>0
5N2(g)+3O2(g) + 6H2O(l) △H2>0
反应Ⅲ:2NO(g) +O2(g)![]() 2NO2(g) △H3<0
2NO2(g) △H3<0
① 反应I在容积固定密闭容器内进行,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法正确的是___。
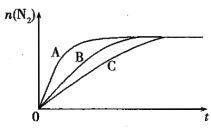
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
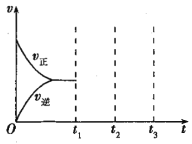
②将物质的量之比为2:1的NO、O2混合气体置于恒温密闭容器中发生反应Ⅲ,正、逆反应速率随时间变化曲线如图所示。在t1时,保持容器压强不变,充入一定量的NO2,t2时建立新的平衡,请在答题纸中画出t1~t3正、逆反应速率随时间变化曲线。___
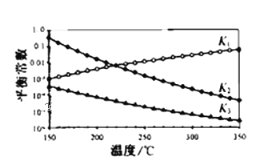
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。则△H2__△H3(填“大于”、“小于”、“等于”),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为Cl2,则丁可能是铁B.若甲为铁,则丁可能是硝酸
C.若甲为AlCl3溶液,则丁可能是氨水D.若甲为NaOH,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Cu、Fe2O3的混合物中加入400 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种零价铁纳米簇可用于水体修复,其处理三氯乙烯(![]() )所形成原电池如图所示。水体中
)所形成原电池如图所示。水体中![]() ,
,![]() ,
,![]() 等离子也发生反应。下列说法正确的是( )
等离子也发生反应。下列说法正确的是( )
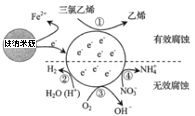
A.零价铁纳米簇发生的电极反应为:Fe-3e-=Fe3+
B.反应①在正极发生,反应②③④在负极发生
C.③的电极反应式为4OH--4e-=O2↑+2H2O
D.三氯乙烯脱去3mol Cl时反应①转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据电化学知识,解决下列问题:
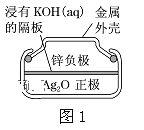
(1)图1为锌银电池,负极是Zn,正极是Ag2O,电解质是KOH。写出该电池负极电极反应式:___,电池工作时,正极区周围溶液的pH___(填“增大”、“减小”、“不变”)。
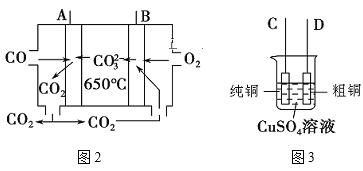
(2)图2是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,图3是粗铜精炼的装置图,现用该燃料电池为电源进行粗铜的精炼实验。
①写出A极的电极反应式:___。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与__极(填“C”或“D”)相连。
③当消耗标准状况下2.24LO2时,C电极的质量变化为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴用途广泛,可用于指示剂和催化剂的制备。用含钴废料(主要成分为![]() ,还含有一定量的
,还含有一定量的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等)制备草酸钴晶体
等)制备草酸钴晶体![]() 的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题:
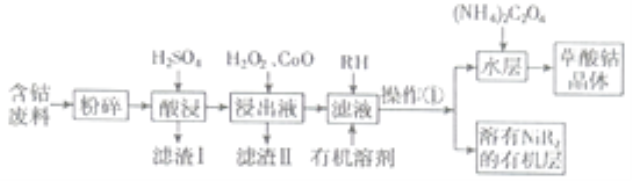
已知:①草酸钴晶体难溶于水
②![]() 为有机物(难电离)
为有机物(难电离)
③相关金属离子![]() 形成氢氧化物沉淀的
形成氢氧化物沉淀的![]() 范围如下:
范围如下:
金属离子 |
|
|
|
|
开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |
(1)滤渣Ⅰ的成分_______。
(2)![]() 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入![]() 后溶液中发生的主要反应的离子方程式______。
后溶液中发生的主要反应的离子方程式______。
(3)加入氧化钴调节浸出液的![]() 的范围是______。
的范围是______。
(4)加入有机溶剂的目的是______。
(5)若仅从沉淀转化角度考虑,能否利用反应![]() 将
将![]() 转化为
转化为![]() ____(填“能”或“不能”),说明理由:______。(已知
____(填“能”或“不能”),说明理由:______。(已知![]() ,
,![]() )
)
(6)为测定制得的草酸钴晶体样品的纯度,现称取样品![]() ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液![]() 。移取
。移取![]() 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用![]() 高锰酸钾溶液滴定,当溶液由__________(填颜色变化),消耗高锰酸钾溶液
高锰酸钾溶液滴定,当溶液由__________(填颜色变化),消耗高锰酸钾溶液![]() ,计算草酸钴晶体样品的纯度为__________
,计算草酸钴晶体样品的纯度为__________![]() 。(用含
。(用含![]() 、
、![]() 、
、![]() 的代数式表示)(已知
的代数式表示)(已知![]() 的摩尔质量为
的摩尔质量为![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
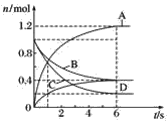
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com