【答案】
分析:(1)常见的含有10电子的分子有:He、HF、H
2O、NH
3、CH
4,X、Y为含有10电子的分子,且X与Z分子中含有的共用电子对数之比为3:4,所以X为NH
3,Y为CH
4;根据反应装置可知用按盐和碱共热制取氨气;
(2)W为10电子离子,W+X+H
2O一白色沉淀,该白色沉淀可能为Mg(OH)
2或Al(OH)
3,根据Al(OH)
3为两性氢氧化物设计实验;
(3)常温下,取10mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化曲线可知:Y为弱电解质HF;HF的强腐蚀性弱酸,具有电离平衡;
(4)分子Z为CH
4,它对应的单质碳可发生题中转化,若n=1,则AB
n为一氧化碳,碳和水蒸气或碳与二氧化硅在高温下可发生置换反应生成一氧化碳.
解答:解:(1)常见的含有10电子的分子有:He、HF、H
2O、NH
3、CH
4,X、Y为含有10电子的分子,且X与Z分子中含有的共用电子对数之比为3:4,所以X为NH
3,Y为CH
4,X的电子式为

;图中反应装置为固固加热装置,用按盐和碱共热制取氨气,常见的为氯化铵和氢氧化钙反应制取氨气,反应的化学方程式为Ca(OH)
2+2NH
4Cl

CaCl
2+2NH
3↑+2H
2O;
(2)W为10电子离子,W+X+H
2O一白色沉淀,该白色沉淀可能为Mg(OH)
2或Al(OH)
3,根据Al(OH)
3为两性氢氧化物设计实验,加入足量的氢氧化钠溶液,若观察到白色沉淀溶解,则证明沉淀为Al(OH)
3,W为Al
3+;若观察到白色沉淀不溶解,则证明白色沉淀为Mg(OH)
2,W为Mg
2+;
(3)若Y为强酸,加水稀释100倍时,pH为a+2,而Y加水稀释100倍时,pH小于a+2,且Y是含有10电子的分子,则Y为弱酸HF;
a、HF的水溶液为氢氟酸,氢氟酸具有强腐蚀性,能刻蚀玻璃,故a正确;
b、盐酸为强电解质,完全电离,氢氟酸为弱电解质,部分电离,相同温度时与相同浓度的盐酸比较,Y的水溶液离子浓度小,的导电能力弱,故b正确;
c、氢氟酸为弱电解质,稀释后,平衡向电离方向移动,但阴离子的物质的量浓度之和减小;
(4)由以上分析可知,分子Z为CH
4,它对应的单质碳可发生题中转化,若n=1,则AB
n为一氧化碳,碳和水蒸气或碳与二氧化硅在高温下可发生置换反应生成一氧化碳,反应的化学方程式为:
(4)C+H
2
CO+H
2或2C+SiO
2
Si+2CO.
故答案为:(1)

,Ca(OH)
2+2NH
4Cl
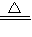
CaCl
2+2NH
3↑+2H
2O;
(2)加入足量的氢氧化钠溶液,若观察到白色沉淀溶解,则证明W为Al
3+;若观察到白色沉淀不溶解,则证明W为Mg
2+;
(3)HF,a、b;
(4)C+H
2
CO+H
2(或2C+SiO
2
Si+2CO).
点评:本题考查常见的含有10电子的微粒的结构和性质,要解答此题,必须掌握它们的结构和性质,并会书写相关的化学方程式.


 ;图中反应装置为固固加热装置,用按盐和碱共热制取氨气,常见的为氯化铵和氢氧化钙反应制取氨气,反应的化学方程式为Ca(OH)2+2NH4Cl
;图中反应装置为固固加热装置,用按盐和碱共热制取氨气,常见的为氯化铵和氢氧化钙反应制取氨气,反应的化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O; CO+H2或2C+SiO2
CO+H2或2C+SiO2 Si+2CO.
Si+2CO. ,Ca(OH)2+2NH4Cl
,Ca(OH)2+2NH4Cl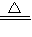 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O; CO+H2(或2C+SiO2
CO+H2(或2C+SiO2 Si+2CO).
Si+2CO).

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案