
下列坐标轴中的x表示元素的核电核数,其中y能表示
的离子半径的是
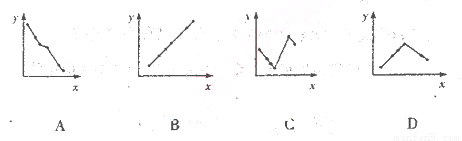
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2013-2014河南省安阳市高三毕业班第二次模拟理综化学试卷(解析版) 题型:简答题
废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,转化反应式如下:
PbSO4(s)+CO (aq)
(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)
①下列说法错误的是:___________________。
A.PbSO4的Ksp比PbCO3的Ksp大
B.该反应平衡时,c(CO )=c(SO42-)
)=c(SO42-)
C.该反应的平衡常数K=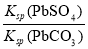
②室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在_________溶液中PbSO4转化率较大,理由是_________。
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是______________。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的SO过,循环利用时可能出现的问题是__________________。
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入__________mL的0.5 mol·L-1 Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:填空题
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。
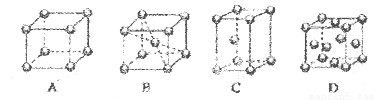
(1)M原子的外围电子排布式为_______________,在周期表中属于___________区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为____(填序号)。其空间利用率为____。
(3) MCl3?6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3,B、[M(H2O)5Cl]Cl2?H2O和C、[M(H2O)4Cl2]Cl?2H2O
为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.10molMCl3·6H2O 配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为___________(填A或B或C)。
(4)常温下为暗红色液体,熔点-96. 5℃,沸点117℃,能与丙酮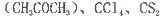 等互溶。
等互溶。
①固态MO2Cl2属于___________晶体;
②中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为______杂化和_____杂化。
(5)+3价M的配合物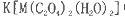 中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:选择题
下列有关化学实验的说法中正确的是
A.烧杯、坩埚、试管、锥形瓶都可以用酒精灯直接加热
B.银镜反应、乙醛与新制Cu(OH)2反应、实验室制取乙烯都必须用水浴加热
C.制取氨气、氢气时都可以用向下排空气法收集
D.石油的分馏、实验室制取乙炔和制取蒸馏水都要用到冷凝装置
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:实验题
(11分)某化学小组设计实验探究碳酸钠、碳酸氢钠的性质,实验如下:取两支试管分别加入10 mL相同浓度的稀盐酸,将两个各装有0 5 g的Na2CO3和NaHCO3粉末的小气球分别套在两个试管上,将气球内的固体粉末同时倒人试管中,已知盐酸足量,观察实验现象。
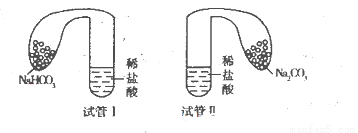
(l)两支试管中均产生气体,其中产生气体较快的为________(填“试管I”或“试管II”),投入________(填化学式)的试管中气球变得比较大。
(2)甲同学触摸上述两试管,发现试管I变冷,试管Ⅱ变热,由此提出不管其状态如何,NaHCO3与HCl反应为吸热反应,Na2CO3与HCl反应为放热反应。
为进一步探究Na2CO3、NaHCO3与盐酸反应的能量变化,乙同学进行下列实验,操作步骤为:①向试剂1中加入试剂2,搅拌、测定温度;②静置、测定温度;③再加入试剂3.搅拌、测定温度、记录。得到以下数据:
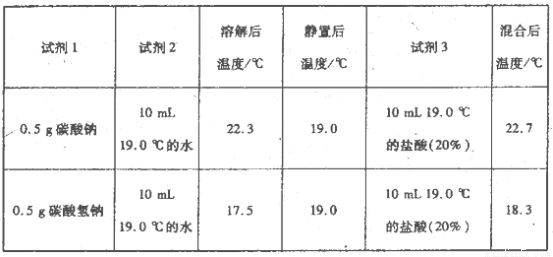
上述实验需要用到的玻璃仪器有________。
乙同学可得出结论:
①NaHCO3的溶解过程________(填“吸热”或“放热”,下同);Na2CO3的溶解过程________。
②CO32-与H+反应为一反应(填“放热”或“吸热”,下同),HCO3-与H+反应为________反应。
(3)比较甲乙同学的实验,你认为 ________(填“甲”或“乙”)的实验方案更合理、更严密。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.元素周期表中一共有7个周期和18个族
B.金属元素的原子最外层电子数一定都小于4
C.质量数不同的两种原子,一定不互为同位索
D.主族元素X的原子序数为a,所在周期的元素种数为b,则与x同族的下一周期的元素Y的原于序数一定为a+b
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:选择题
纽约一家公司设计出Soccket足球,每被踢一下,足球的内置机制就会把能量储存起来;被储存的能量可以通过USB接口给手机或其他小家电充电。在Soccket足球充放电的过程中,能量转化的主要形式是

A.电能→ 化学能→电能 B.化学能→电能→化学能
C,机械能→电能→化学能 D.机械能→化学能→电能
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
在一定温度下,10 mL 0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30mol/L
D.反应到6 min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com