
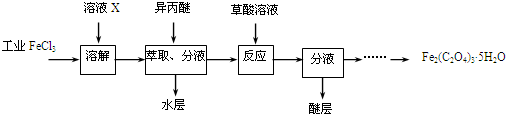
分析 (1)氯化铁人员占得到溶质固体可以通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,在氯化氢气流中加热失去结晶水,抑制铁离子的水解得到固体氯化铁;
(2)①酸化FeCl3用盐酸酸化,不引入杂质;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失;故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;根据高锰酸钾的量计算草酸的含量,
a.没有润洗导致高锰酸钾浓度低消耗体积多;
b.读数高锰酸钾体积多;
c.读数体积偏小,结果偏低.
解答 解:(1)实验室中可将FeCl3溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化铁晶体FeCl3•6H2O,将FeCl3•6H2O在HCl的气氛中加热,抑制铁离子水解脱水得到无水FeCl3.
故答案为:蒸发(浓缩)、冷却(结晶);将FeCl3•6H2O在HCl的气氛中加热脱水;
(2)①酸化FeCl3用盐酸酸化,不引入杂质,且抑制铁离子的水解,
故答案为:(浓)盐酸;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好,
故答案为:FeCl3在异丙醚中的溶解度大于其在水中的溶解度;取少量溶液,向其中滴加少量KSCN溶液,若溶液变红,则含有Fe3+;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失,
故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;
a.没有润洗导致高锰酸钾浓度低消耗体积多,偏高;
b.读数高锰酸钾体积多,偏高;
c.读数体积偏小,结果偏低,正确;
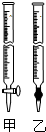
故答案为:甲;c.
点评 本题考查盐类水解盐类分析,草酸铁晶体[Fe2(C2O4)3•5H2O]的制备,涉及试验流程问题,根据物质的性质进行分析处理,难度中等.


科目:高中化学 来源: 题型:解答题
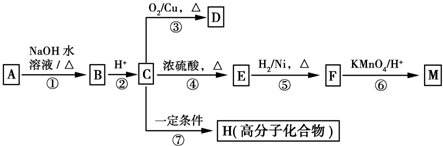
 $→_{H+}^{KMnO_{4}}$
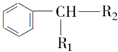
$→_{H+}^{KMnO_{4}}$ 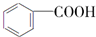 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)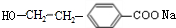 .
.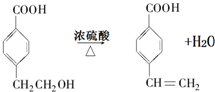 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 水中的溶解度:Na2CO3<NaHCO3 | ||
| C. | 铜与硫磺反应生成硫化铜 | D. | 氨气与氯化氢气体反应生成白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
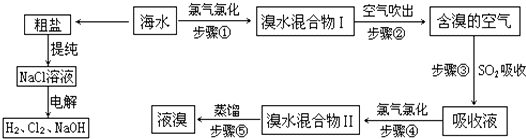
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 品红的分子式为C20H18N3 | |
| B. | 上述漂白原理反应属加成反应 | |
| C. | 碱性品红及与H2SO3生成的无色化合物都可与NaOH溶液反应 | |
| D. | 该无色化合物受热容易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
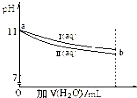
| A. | I 和 II 溶液中,离子种类数相同 | |
| B. | a 点处,I 溶液的浓度为 10-3mol?L-1 | |
| C. | a 点处,I、II 对水的电离平衡影响相同 | |
| D. | b 处的 I、II 溶液分别与盐酸反应,I 消耗 HCl 物质的量比 II 多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com