
| A. | 对苯二甲酸 | B. | 丙酸 | C. | 乙二醇 | D. | 乙酸 |
科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
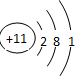
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C02分子比例模型示意图: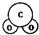 | B. | O原子核外电子轨道表示式: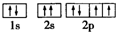 | ||
| C. | Ca2+电子排布式:ls22s23s23p6 | D. | K原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
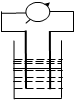 在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )| M | N | P | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 铜 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
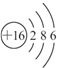 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
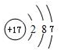 .②的氢化物含有化学键的类型是共价键,与②的氢化物分子所含电子总数相等的分子是H2O(举一例、填化学式,下同)、离子是OH-.
.②的氢化物含有化学键的类型是共价键,与②的氢化物分子所含电子总数相等的分子是H2O(举一例、填化学式,下同)、离子是OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 溶液中加入等物质的量浓度等体积的澄清石灰水:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| B. | Ca(ClO)2 溶液中加入Na2SO3 溶液 Ca2++SO32-═CaSO3↓ | |
| C. | 食醋溶解蛋壳:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO- | |
| D. | 将少量CO2气体通入 溶液中:CO2+H2O+ 溶液中:CO2+H2O+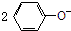 → → +CO32- +CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com