
【题目】下列离子方程式正确的是( )
A.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+
C.将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:OH+Ca2++HCO=CaCO3↓+H2O
D.往苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol OH﹣含有的电子数为9NA
B.标准状况下,NO2和N2O4的混合物23g中含有NA个氧原子
C.常温常压下,2.8gN2和2.24L CO所含电子数均为1.4NA
D.标准状况下,22.4 L 乙醇中含有NA个乙醇分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是重要的化学反应,在人类的生产和生活中无处不在。
(1)已知反应:BaSO4+C——BaS+CO↑
①配平该反应___。
②若有2.33gBaSO4发生反应,则反应过程中转移电子的数目是__,标准状况下,生成一氧化碳___L。
(2)已知反应:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O;
①配平并用“双线桥法”表示上述反应中电子转移的方向和数目___。
②该反应中氧化剂与还原剂的物质的量之比为__;写出该反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成___而使Cu2O产率降低。
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=___。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
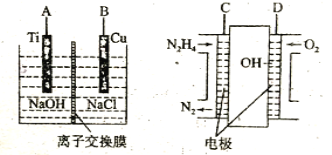
①上述装置中B电极应连___电极(填“C”或“D”)。
②该离子交换膜为___离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为___。
③原电池中负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
I (pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
II(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
IV(pH=4,含 Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.由于Cu2+存在,IV中M的分解速率比I快
B.其它条件相同时,水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比II
D.在0~20 min内,I中M的平均分解速率为0.015mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应既不属于氧化还原反应又不属于四种基本反应类型的是( )
A.Cl2+2KBr=Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.3O2 ![]() 2O3D.2CO+O2
2O3D.2CO+O2![]() 2CO2
2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)简单鉴别Fe(OH)3胶体和FeCl3溶液的方法是_______________。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请用双线桥表示出电子转移的方向和数目_____________________
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则可检出待测液中含有的金属阳离子是_____;
②验证该溶液中含有Fe2+,正确的实验方法是_______(用字母代号填)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
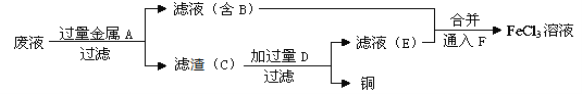
①滤渣C的主要成分的化学式为_______、_______。
②加过量D发生反应的离子方程式为__________________________________。
③通入F发生反应的化学方程式为 ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO和H2组成的混合气体2.4g在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. 1.2g B. 2.4 g C. 3.6![]() g D. 无法计算
g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列计算结果正确的是( )
A.将25gCuSO4·5H2O硫酸铜晶体溶解在975g水中,所得溶液溶质的质量分数为2.5%
B.0.23gNa与9.77gH2O完全反应,所得溶液溶质的质量分数为2.3%
C.7.8gNa2O2与92.2gH2O完全反应,所得溶液溶质的质量分数为8.0%
D.32.2gNa2SO4·10H2O溶于水配成500 mL溶液中,离子的物质的量浓度为0.6mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com