
分析 (1)①取少量溶液于试管中,逐滴加入浓氢氧化钠溶液,发现开始生成白色沉淀,则不含Fe3+,白色沉淀迅速变为灰绿色,最后变为红褐色,说明含有Fe2+,则一定不含CO32-,同时伴有刺激性气体放出,应为氨气,说明含有Fe2+;
②另取少量溶液于试管中,加入足量盐酸酸化后再滴加氯化钡溶液,有白色沉淀生成,说明含有SO42-,则不含Ba2+;
(2)乙同学进行如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,说明含有Fe2+,不含Fe3+;继续滴加H2O2,红色逐渐褪去且有气泡产生,发生H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+,反应中N、S盐酸化合价升高,被氧化,结合化合价的变化以及物质的性质解答该题.
解答 解:(1)取少量溶液于试管中,逐滴加入浓氢氧化钠溶液,发现开始生成白色沉淀,则不含Fe3+,白色沉淀迅速变为灰绿色,最后变为红褐色,说明含有Fe2+,发生反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,则一定不含CO32-,同时伴有刺激性气体放出,应为氨气,说明含有Fe2+;
②另取少量溶液于试管中,加入足量盐酸酸化后再滴加氯化钡溶液,有白色沉淀生成,说明含有SO42-,则不含Ba2+,所以一定含有的离子是Fe2+、SO42-、NH4+,
故答案为:Fe2+、SO42-、NH4+; 4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)①乙同学进行如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,说明含有Fe2+,不含Fe3+;继续滴加H2O2,红色逐渐褪去且有气泡产生,发生H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+,反应中N、S盐酸化合价升高,S元素化合价有-2价升高到+6价,N元素化合价由-3价升高到0价,被氧化,每生成lmol CO2,有方程式可知生成1molSO42-,0.5mol+N2,转移的电子的物质的量为1mol×8+0.5mol×2×3=11mol,为11NA个,
故答案为:N、S;11;
②由反应的先后顺序可知过氧化氢先氧化Fe2+,则Fe2+还原性较强,
故答案为:>;
③若乙同学猜测正确,则褪色后的溶液于中滴加KSCN溶液,溶液会恢复红色,所以验证方法为:取少量褪色后的溶液于试管中,滴加KSCN溶液,若溶液恢复红色,证明乙同学推断正确,
故答案为:取少量褪色后的溶液于试管中,滴加KSCN溶液,若溶液恢复红色,证明乙同学推断正确.
点评 本题考查了常见离子的性质及检验方法,为高频考点,题目难度中等,注意掌握离子反应发生条件,明确常见离子的检验方法,试题培养了学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于过量的氢酸碘中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+CO32- | |
| C. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下:
乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下: +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$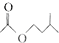 +H2O
+H2O| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙醇 | 60 | 1.0492 | 118 | 溶 |
| 乙醇异戊酯 | 130 | 0.8670 | 142 | 难溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题:
如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com