
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)请用离子方程式表示以上工艺流程中第①步反应:___________________ 。
(2)写出以上工艺流程中第③步反应的化学方程式:______________________。
(3)金属铝与氧化铁混合点燃,会发生剧烈的反应。该反应的化学方程式 _____________。请举一例该反应的用途______________________。
(4)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是 _____。
【答案】(1)Al2O3+2OH-=2AlO2-+H2O
(2)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3或2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
(3)2Al+Fe2O3![]() 2Fe+Al2O3焊接钢轨(4)5.4g
2Fe+Al2O3焊接钢轨(4)5.4g
【解析】
试题分析:(1)Al2O3和氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O;
(2)向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)金属铝在高温下可以和氧化铁发生铝热反应:2Al+Fe2O3![]() 2Fe+Al2O3,获得金属铁,铁以铁水的形式生成,这样可以来焊接钢轨;
2Fe+Al2O3,获得金属铁,铁以铁水的形式生成,这样可以来焊接钢轨;
(4)电解熔融氧化铝制取金属铝2Al2O3![]() 4Al+3O2↑,反应转移电子为12mol,若有0.6mol电子发生转移,则能得到金属铝的质量是
4Al+3O2↑,反应转移电子为12mol,若有0.6mol电子发生转移,则能得到金属铝的质量是![]() =5.4g。
=5.4g。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是

A. 乙烧杯中发生还原反应
B. 甲烧杯中溶液的pH逐渐减小
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. 外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O
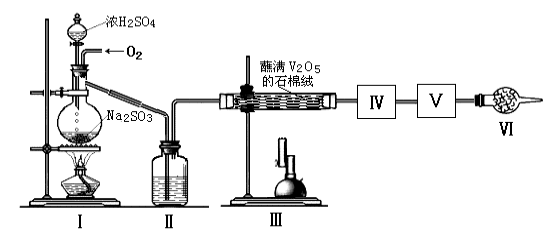
(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。
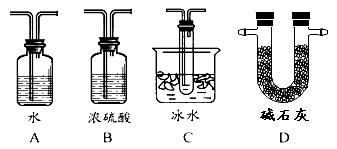
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先_______后_________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用18.9gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了7.2g,则实验测得SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A、100mL量筒
B、托盘天平
C、玻璃棒
D、50mL容量瓶
E、10mL量筒
F、胶头滴管
G、50mL烧杯
H、100mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有 (填字母)
(3)下列操作会导致所配溶液浓度偏低的是________(填序号)
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶使用前未进行干燥
④没有洗涤溶解时所用的烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容积的容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是( )
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是( )
A. SO2为0.4 molL-1,O2为0.2 molL-1 B. SO2为0.25 molL-1
C. SO2、SO3均为0.15 molL-1 D. SO3为0.4 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含30%SiO2、40.8% Al2O3、和少量的 Fe2O3等)干法制取该合金的工艺如下:
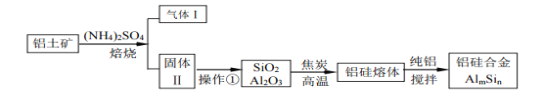
(1)铝硅合金中若含有铁,会影响其抗腐蚀性能,原因是_____________________
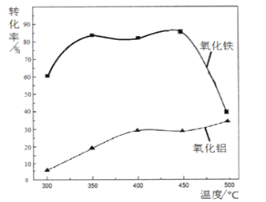
(2)焙烧除铁反应时,Fe2O3转化为NH4Fe(SO4 )2,Al2O3 少部分发生类似反应,写出Fe2O3反应的化学方程式:_____________________。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜的焙烧温度是________________
(3)若操作①所得的溶液中加入过量的NaOH溶液,含铝微粒发生的离子反应方程式是:_______________________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体SiC再与Al2O3生成硅、铝单质的化学反应方程式,_________________________。
(5)已知25℃ Ksp[Al(OH)3]=1.0×10-33 , Ksp[Fe(OH)3]=4.0×10-38,向FeCl3和AlCl3的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3和Fe(OH)3 沉淀,当两种沉淀共存时,上层清液中c(Al3+):c(Fe3+)==___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2 (g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
B.500℃、30MPa下,将0.5 molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热193kJ,其热化学方程式为:N2+3H2![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
C.活化能的作用在于使反应物活化,所以化学反应的活化能不可能接近于零或等于零
D.常温下,反应C(s)+ CO2 (g)=2CO(g)不能自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6 H12O6,二者互为同分异构体
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com