
| A. | 铜锌原电池中铜是负极 | |
| B. | 用电解法精炼粗铜时,纯铜作阳极 | |
| C. | 在镀件上电镀铜时可用金属铜作阳极 | |
| D. | 电解稀硫酸制H2、O2时,铜作阳极 |
分析 A.锌的活泼性大于铜,则锌为负极,铜为正极;
B.电解精炼铜时,阳极发生氧化反应,则阳极为粗铜;
C.电镀时,镀件为阴极,镀层金属为阳极;
D.若铜为阳极,阳极铜失去电子生成铜离子,则阳极不会生成氧气.
解答 解:A.铜锌原电池中,活泼性较强的为负极,则Zn为负极、Cu为正极,故A错误;
B.用电解法精炼粗铜时,阳极发生氧化反应、阴极发生还原反应,则纯铜作阴极,粗铜为阳极,故B错误;
C.在镀件上电镀铜时,镀件为阴极,阳极为镀层金属,所以可用金属铜作阳极,故C正确;
D.电解稀硫酸制H2、O2时,若铜作阳极,则阳极铜放电,阳极生成的为铜离子,不会生成氧气,所以阳极应该为惰性电极,故D错误;
故选C.
点评 本题考查了原电池、电解池工作原理,题目难度不大,涉及电镀、粗铜冶炼等知识,明确原电池、电解池工作原理为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
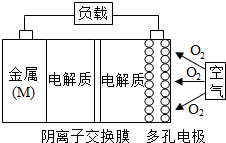 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 比较Mg,Al,Zn三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| C. | M-空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne-=4M(OH)n | |
| D. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | 原子核外各电子层容纳的电子数为2n2个 | |
| C. | 核外电子的分层排布就是核外电子的分层运动 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
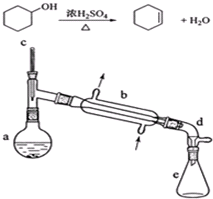
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氨水混合:H++OH-═H2O | |
| B. | 金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠与过量稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气与碘化钾溶液的反应:Cl2+I-=I2+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为O2+4e-═2O2- | |
| B. | 放电时溶液中的阳离子向正极方向移动 | |
| C. | 该电池反应为CH4+2O2═CO2+2H2O | |
| D. | 通入CH4一极的电极反应式为CH4+2O2+8e-═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com