
【题目】降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
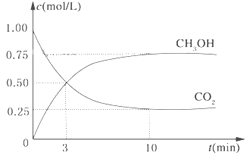
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(Lmin);
(2)氢气的转化率=______;
(3)该反应的平衡常数为______(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是______。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol H2
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1______c2的关系(填“>”、“<”或“=”)
【答案】0.225 75% 5.33 CD <
【解析】
(1)根据反应的化学方程式可知
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 1 3 0 0
转化浓度(mol/L) 0.75 2.25 0.75 0.75
平衡浓度(mol/L) 0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=![]() =0.225molL-1min-1;
=0.225molL-1min-1;
(2)氢气的转化率=![]() ×100%=75%;
×100%=75%;
(3)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=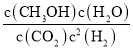 =
=![]() =5.33;
=5.33;
(4)A、要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动。因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,A错误;
B、充入He(g),使体系压强增大,但物质浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,B错误;
C、将H2O(g)从体系中分离,平衡向正反应方向移动,n(CH3OH)/n(CO2)增大,C正确;
D.再充入1molH2,平衡向正反应方向移动,n(CH3OH)增大,n(CO2)减小,则n(CH3OH)/n(CO2)增大,D正确。
答案选CD。
(5)当反应达到平衡时,向容器中再加入一定量H2,氢气浓度增大,平衡向正反应方向移动,但平衡的移动不能完全抵消氢气浓度的增大,故达到新的平衡状态后,氢气浓度一定比原平衡状态大,即c1<c2。


科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是

A. 升高温度平衡常数K增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.0.1molC4H4(键线式:![]() )含共价键数目为0.4NA
)含共价键数目为0.4NA
B.30g冰醋酸和乳酸(C3H6O3)的混合物中含氢原子的数目为2NA
C.常温下,0.5mol/L的氨水溶液中氢氧根数目小于0.5NA
D.6.4g铜粉与3.2g硫粉混合隔绝空气加热充分反应,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
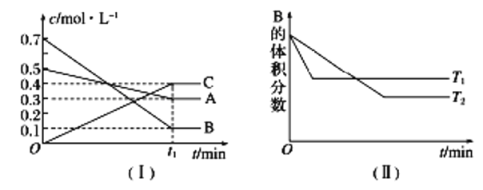
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为________,正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有______(填字母序号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.N2电子式为![]()
B.Cl-的结构示意图为![]()
C.CO2的结构式为O—C—O
D.氯化镁的电子式:Mg2+[C![]() ]
]![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基钠(NaNH2)常用作有机合成的促进剂,是合成维生素 A 的原料。某学习小组用如下装置,以NH3和Na为原料加热至 350-360 ℃制备氨基钠,并检验其生成的产物和测定产品的纯度。
已知:NaNH2极易水解且易被空气氧化。回答下列问题 :
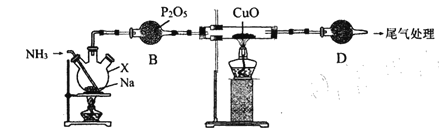
A C
(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是________(填字母序号)。
A.浓氨水、CaO B. NH4Cl固体、Ca(OH)2固体
C.浓氨水 D.NH4NO3固体 、NaOH固体
(2)仪器D名称为___________,其中盛放的试剂为 ___________。
(3)装置A中发生反应的化学方程式为 __________,能证明装置A中已发生反应的实验依据是__________________________ 。
(4) 装置B的作用是______________ 。
(5) 制备时,通入的氨气过量,待钠充分反应后,取 mg 产品, 按如图装置进行实验(产品所含杂质仅为 Na2O )。
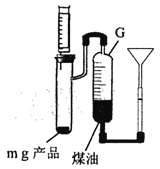
用注射器向试管中缓慢加入H2O至恰好完全反应立即停止,G中液面从刻度V1变 为 V2(已知V2>Vi,单位 mL,忽略固体体积,读取刻度时保持两使液面相平,实验过程处于标准状况下),则产品纯度为________:若读取V1时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度_________(填“偏高”、“ 偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各200mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体NH3 0.06mol;第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量变为4.66g。 根据上述实验,下列推测正确的是( )
A.一定存在K+和NH4+
B.200mL溶液中含0.02mol CO32-
C.Ba2+一定不存在,Mg2+可能存在
D.4.66g沉淀中含BaCO3和BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)下列叙述正确的有_______________
A.第四周期元素中,锰原子价电子层中未成对电子数最多
B.第二周期主族元素的原子半径随核电荷数增大依次减小
C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小
(Ⅱ)M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
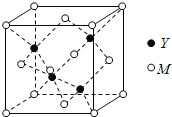
①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com