
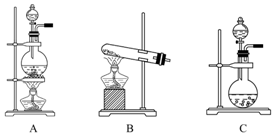
 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2-→O2 | |
| ② | 制氨气 | NH4Cl-→NH3 | |
| ③ | 制氯气 | HCl-→Cl2 |
分析 (1)①制氧气③制氯气是氧化还原反应,②制氨气是复分解反应;
(2)①制氧气是液体与固体混合不加热制气体应选装置C,②制氨气是加热固体混合物制气体应选装置B,③制氯气是加热液体与固体混合物制气体应选装置A;(3)若选择液体与固体混合不加热制氨气,就选择浓氨水与生石灰或氢氧化钠固体制备氨气;
(4)根据氨气和二氧化碳在水中的溶解度判断;
(5)①根据溶液稀释前后溶质的物质的量不变进行计算;
②根据配制一定物质的量浓度的溶液需用实验仪器;
③容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液.
解答 解:(1)从反应原理看,明显不同于其他两种气体的是制备氨气利用的是复分解反应
利用过氧化氢分解制氧气,利用氯化铵和氢氧化钙固体加热发生复分解反应制氨气,利用二氧化锰氧化浓盐酸制氯气,所以需要氧化剂的是制备氯气,其中氨气是碱性气体化合物,氧气是中性气体单质,氯气是氧化性气体单质;从反应原理看,明显不同于其他两种气体的是制备氨气利用的是复分解反应,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:②;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)依据制备气体的试剂状态,反应条件分析判断,固体+液体加热制气体的装置选择A;固体+固体加热制气体的装置选择B;固体+液体不加热制气体的装置为C;过氧化氢分解制氧气不需要加热选择C,利用氯化铵和氢氧化钙固体加热发生复分解反应制氨气,选择B,利用二氧化锰氧化浓盐酸加热制氯气选择A,或用高锰酸钾和浓盐酸不加热反应制氯气,选择C;
故答案为:①C ②B ③A或C;
(3)制备氧气是利用分液漏斗滴入液体到固体发生的反应,所以用来制备氨气可以利用浓氨水滴入固体氧化钙或氢氧化钠固体中发生反应制备;
故答案为:浓氨水和氢氧化钠(或生石灰等);
(4)氨气极易溶于水,而二氧化碳微溶于水,制取时应先通入NH3;碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl,
故答案为:NH3;CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;
(5)①溶液稀释前后溶质的物质的量不变,则有8mol/L×0.1L=V×12mol/L,
V=0.0667L=66.7mL;
故答案为:66.7;
②制备Cl2需用8mol•L-1的盐酸1OOml,需用100mL量筒、玻璃棒、胶头滴管、烧杯、lOOmL容量瓶;
故答案为:ACFGH;
③容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液,容量瓶在使用前要检查是否漏水,定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次,使溶液充分混合,则不正确的是BC.
故答案为:BC.
点评 本题考查物质的制备、溶液的配制等基本实验操作,为高频考点,侧重考查学生的分析能力和实验能力,题目难度不大,本题注意把握物质的性质,为解答该类题目的关键,学习中注意积累,(4)的反应原理类似于侯氏制碱法.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mo lCl2参加反应转移电子数一定为2NA | |
| B. | 一定条件下,足量铜与200g98%的浓硫敌充分反应,转移电子数为2NA | |
| C. | 300mL 2mol/L蔗糖溶液中所含蔗糖分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
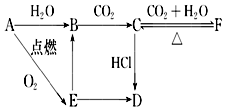 A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末:
A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 品红溶液中分别通入SO2和Cl2,品红均褪色 | |
| B. | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | |
| C. | 分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结 | |
| D. | 溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| B. | 饱和Mg(OH)2溶液与饱和MgF2 溶液相比,前者的c(Mg2+)大 | |
| C. | Mg(OH)2固体在0.01mol/L氨水中的Ksp比在 0.01mol/L NH4Cl 溶液中的Ksp小 | |
| D. | 在Mg(OH)2的悬浊液加入NaF 溶液后,不可能有MgF2沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com