
【题目】下表是元素周期表中的一部分元素,用元素符号或化学式回答下列问题:

(1)h元素在周期表中的位置是_______;
(2)表中所列元素中,金属性最强的是____;元素最高价含氧酸酸性最强的是____;(填化学式)
(3)c、d、e、g中,离子半径最小的是____;(填离子符号)
(4)a和b化合时形成_____键;a和d化合时形成______键;
(5)由a、c、d形成的化合物的电子式为__________。
【答案】第四周期,第Ⅷ族 Na HClO4 Al3+ 共价 离子 ![]()
【解析】
由元素在周期表中的位置可知,a为H元素、b为N元素、c为O元素、d为Na元素、e为Al元素、f为Si元素、g为Cl元素、h为Fe元素,据此分析解答。
由元素在周期表中的位置可知,a为H元素、b为N元素、c为N元素、d为Na元素、e为Al元素、f为Si元素、g为Cl元素、h为Fe元素。
(1)h为Fe元素,在周期表中的位置是第四周期,第Ⅷ族;
(2)同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;同主族从上到下,金属性逐渐增强,非金属性逐渐减弱;表中所列元素中,金属性最强的元素应在表的左下角,是Na;元素的非金属性越强,最高价氧化物的水化物的酸性越强,但F元素无最高价氧化物的水化物,故以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;
(3)具有相同电子层结构的离子核电荷数越大,离子半径越小,故离子半径O2->Na+>Al3+,比其他离子多一个电子层,半径最大,故c、d、e、g中离子半径Cl->O2->Na+>Al3+,离子半径最小的是Al3+;
(4)a和b化合时生成NH3,形成共价键;a和d化合时生成NaH,形成离子键;
(5)由a、c、d形成的化合物NaOH的电子式为![]() 。
。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关材料的叙述中,错误的是
A. 合金具有许多优良的物理、化学或机械性能
B. 硅单质是光导纤维的主要成分
C. 硅酸盐产品有陶瓷、玻璃、水泥等
D. 普通玻璃是以纯碱、石灰石和石英为原料制成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)下列纯净物中:a.NaOH b.Ar c.MgCl2 d.HCl e.NH3 f.KNO3
①不含化学键的物质是_______(填序号,下同)。
②既含有离子键又含有共价键的物质是______。
③只含有离子键的物质是________。
(2)下列变化中,不需要破坏化学键的是______。
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
(3)实验室盛放碱液的试剂瓶不能用玻璃塞,以氢氧化钠为例,用离子方程式表示其原因:_________,任写一个制造普通玻璃的主要反应的化学方程___________________。
(4)硅是良好的半导体材料,写出工业上生产粗硅的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 液态HCl不导电,所以HCl是非电解质
B. BaSO4溶于水的部分能够电离,所以BaSO4是电解质
C. 液态Cl2不导电,所以Cl2是非电解质
D. NH3的水溶液能够导电,所以NH3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
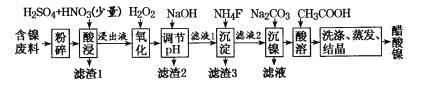
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
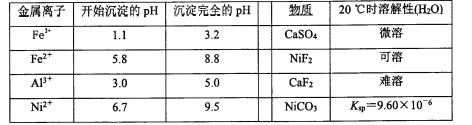
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
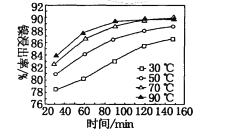
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)
![]()
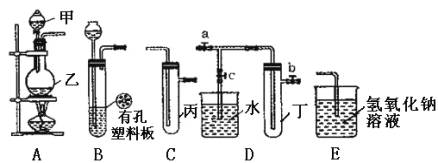
(1)甲、乙两仪器的名称是 ______、 _______。
(2)在甲中装入浓硫酸,乙中装入铜片,连接A、C、E进行实验,写出A中发生反应的化学方程式___;若丙中装入的是品红溶液,则反应后的现象是_____;若丙中装入的是酸性高锰酸钾溶液,反应后溶液褪色,说明生成的气体有___性;若丙中装入的是氢硫酸溶液,反应后溶液变浑浊,说明生成气体有____性。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上)可制得NO2并进行有关实验。
①要在丁中收集NO2气体,应采取的操作步骤为:关闭止水夹___,打开止水夹____;
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹ab,再打开止水夹c,使烧杯中的水进入试管丁中的操作是_____。
③试管丁中的NO2与水充分反应后,所得溶液中溶质的物质的量浓度是____(保留2位有效数值,气体按标准状况计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是
A. 明矾做净水剂:Al3++ 3H2O = Al (OH)3↓+ 3H+
B. 小苏打治疗胃酸过多:CO32-+ 2H+= CO2↑+ H2O
C. 漂白液加白醋,提高漂白效率:CH3COOH + ClO-=HClO + CH3COO-
D. 酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I-+ O2+2H2O= 2I2+ 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni为第Ⅷ 族元素,在许多工业生产中都有涉及。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式__________________________。
(3)pH的调控范围为 __________________,滤渣Ⅱ的成分为_____________________________。
(4)写出“沉镍”时反应的离子方程式___________________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________________,当Ca2+沉淀完全时,溶液中c(F-)>_____________ mol/L(写出计算式即可)。
(5)操作a的内容是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com