
����Ŀ�����仯�����������й㷺��;�������λ��ͬ���壬���������ƵĻ�ѧ���ʡ�
(1)���������Ӧ���� BCl3���ڸ÷����У���ԭ���������__________�����ӡ�
(2)��������������Һ��Ӧ���� Na[B(OH)4]�����ǻ��������ƣ����������÷�Ӧ�Ļ�ѧ����ʽΪ____________��
(3)B(OH)3(����)��һԪ���ᣬ����ˮ�����ư��ĵ��룺 NH3+H2O![]() +OH- ��������ˮ�е���ķ���ʽΪ____��
+OH- ��������ˮ�е���ķ���ʽΪ____��
(4)NaBH4 ���л��ϳ�����Ҫ�Ļ�ԭ������ҵ�Ϻϳɷ���֮һ�ǣ�Na2B4O7 +16Na+8H2 +7SiO2 ![]() 7Na2SiO3 +4NaBH4 ���ڸ÷�Ӧ�У���������___________���Ʊ�1 mol NaBH4ʱת�� ____________mol ���ӡ�
7Na2SiO3 +4NaBH4 ���ڸ÷�Ӧ�У���������___________���Ʊ�1 mol NaBH4ʱת�� ____________mol ���ӡ�
(5)NaBH4��ˮ��Ӧ����Na[B(OH)4]��һ�����壬д����ѧ����ʽ��_____________��
���𰸡�6 2B��2NaOH��6H2O��2Na[B(OH)4]��3H2�� H3BO3+H2O [B(OH)4]-+H+ H2 4 NaBH4+4H2O��Na[B(OH)4]+4H2��
��������
(1) Bԭ���������3�����ӣ���������Ӧ���� ��BCl3�������γ�3��B-Cl�������ݴ˷����жϣ�
(2) ��������������Һ��Ӧ���� Na[B(OH)4]���������ݴ���д��Ӧ�Ļ�ѧ����ʽ��
(3)����[B(OH)3]��һԪ���ᣬ����ˮ�����ư��ĵ��룺 NH3+H2O![]() +OH- ����������εĻ�ѧʽΪNa[B(OH)4]��д������ˮ�еĵ��뷽��ʽ��
+OH- ����������εĻ�ѧʽΪNa[B(OH)4]��д������ˮ�еĵ��뷽��ʽ��
(4) ��ӦNa2B4O7 +16Na+8H2 +7SiO2![]() 7Na2SiO3 +4NaBH4��Na�Ļ��ϼ���0�����ߵ�+1�ۣ�HԪ�صĻ��ϼ���0�۽���Ϊ-1�ۣ����������ԭ��Ӧ�Ĺ��ɷ������
7Na2SiO3 +4NaBH4��Na�Ļ��ϼ���0�����ߵ�+1�ۣ�HԪ�صĻ��ϼ���0�۽���Ϊ-1�ۣ����������ԭ��Ӧ�Ĺ��ɷ������
(5)NaBH4��HΪ-1�ۡ�BΪ+3�ۣ�-1�۵�����ˮ��+1���ⷢ��������ԭ��Ӧ����H2��ͬʱ����Na[B(OH)4]���ݴ���д��Ӧ�Ļ�ѧ����ʽ��
(1)Bԭ���������3�����ӣ���������Ӧ���� BCl3���÷������γ�3��B-Cl��������ԭ���������6�����ӣ��ʴ�Ϊ��6��
(2)B��Al�����ʾ��������ԣ���������������Һ��Ӧ���� Na[B(OH)4]����������Ӧ�Ļ�ѧ����ʽΪ2B��2NaOH��6H2O��2Na[B(OH)4]��3H2�����ʴ�Ϊ��2B��2NaOH��6H2O��2Na[B(OH)4]��3H2����
(3)����[B(OH)3]��һԪ���ᣬ����ˮ�����ư��ĵ��룺 NH3+H2O![]() +OH- �������εĻ�ѧʽΪNa[B(OH)4]����������ˮ�еĵ��뷽��ʽ�ǣ�H3BO3+H2O [B(OH)4]-+H+���ʴ�Ϊ��H3BO3+H2O [B(OH)4]-+H+��
+OH- �������εĻ�ѧʽΪNa[B(OH)4]����������ˮ�еĵ��뷽��ʽ�ǣ�H3BO3+H2O [B(OH)4]-+H+���ʴ�Ϊ��H3BO3+H2O [B(OH)4]-+H+��
(4) Na2B4O7 +16Na+8H2 +7SiO2![]() 7Na2SiO3 +4NaBH4����Ӧ��Na�Ļ��ϼ���0�����ߵ�+1�ۣ�HԪ�صĻ��ϼ���0�۽���Ϊ-1�ۣ����������Ϊ��������ԭ��Ϊ�ƣ���Ӧ��ת��16�����ӣ����Ʊ�1 mol NaBH4ʱת��4mol ���ӣ��ʴ�Ϊ��H2��4��
7Na2SiO3 +4NaBH4����Ӧ��Na�Ļ��ϼ���0�����ߵ�+1�ۣ�HԪ�صĻ��ϼ���0�۽���Ϊ-1�ۣ����������Ϊ��������ԭ��Ϊ�ƣ���Ӧ��ת��16�����ӣ����Ʊ�1 mol NaBH4ʱת��4mol ���ӣ��ʴ�Ϊ��H2��4��
(5)NaBH4��HΪ-1�ۡ�BΪ+3�ۣ�-1�۵�����ˮ��+1���ⷢ��������ԭ��Ӧ����H2���൱��ˮ���������������NaBH4��-1�۵�H��ͬʱ����Na[B(OH)4]����Ӧ�Ļ�ѧ����ʽΪ��NaBH4+4H2O��Na[B(OH)4]+4H2�����ʴ�Ϊ��NaBH4+4H2O��Na[B(OH)4]+4H2����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������ǵ�����������ʡ�
(1)�γ������ԭ��֮һ�ɼ�ʾ���£�
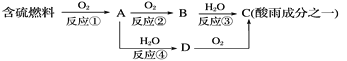
�ش��������⣺
�������pH________(���������������=��)5.6��
��D���ʵĻ�ѧʽΪ____________��
�۷�Ӧ�ڵĻ�ѧ����ʽΪ_________________________________________��
(2)��һ�������°��������������������ת��Ϊ����Ⱦ�����ʡ�д�������Ͷ���������һ�������·�Ӧ�Ļ�ѧ����ʽ��__________________����Ӧ����������____________����ԭ����_______________��
(3)������������Һ�������շ����еĵ��������Ӧ�Ļ�ѧ����ʽ���£�
NO2+NO+2NaOH===2NaNO2+H2O��2NO2+2NaOH===NaNO2+NaNO3+H2O
����VLijNaOH��Һ����ȫ����n molNO2��m molNO��ɵĴ�����Ⱦ�
�������ռ���Һ�����ʵ���Ũ������Ϊ________ mol��L1��
����������Һ��c(NO3��)��c(NO2��)=1��9����ԭ���������NO2��NO�����ʵ���֮��n��m=______��
���ú�n��m�Ĵ���ʽ��ʾ������Һ��NO3����NO2��Ũ�ȵı�ֵc(NO3��)��c(NO2��)=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��д��ȷ���ǣ� ��
A. CaCO3�ĵ��뷽��ʽ��CaCO3 ![]() Ca2+��CO32��
Ca2+��CO32��
B. H2SO3�ĵ��뷽��ʽH2SO3![]() 2H����SO32��
2H����SO32��
C. CO32����ˮ�ⷽ��ʽ��CO32����2H2O![]() H2CO3��2OH��
H2CO3��2OH��
D. HCO3����ˮ��Һ�еĵ��뷽��ʽ��HCO3����H2O![]() H3O����CO32��
H3O����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����0.1000 mol/L NaOH��Һ�ζ�δ֪Ũ�ȵ�������Һ�������ɷֽ�Ϊ���¼�����
A.������ˮϴ�ɾ��ζ��ܣ�B. �ô��ⶨ����Һ��ϴ��ʽ�ζ��ܣ�C.����ʽ�ζ���ȡϡ����20.00 mL��ע����ƿ�У������̪��D.��ȡ��ƿ�����ظ�����һ�Σ�E.���ζ����Ƿ�©ˮ��F.ȡ�¼�ʽ�ζ����ñ���NaOH��Һ��ϴ����Һע���ʽ�ζ��ܡ�0���̶�����2��3 cm�����ٰѼ�ʽ�ζ��̶ܹ��ã�����Һ������0���̶Ȼ�0���̶����£�
G.����ƿ���ڵζ������棬ƿ�µ�һ�Ű�ֽ���ߵα�ҡ����ƿֱ���ζ��յ㣬���µζ���Һ�����ڿ̶ȡ����������գ�
��1����ȷ������˳����(�������ĸ��д)_____________��
��2������F��Ӧ��ѡ��ͼ��________�ζ���(����)��
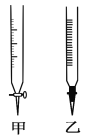
��3���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�________��
A. �ζ�����Һ��ı仯 B. ��ƿ����Һ��ɫ�ı仯
�ζ��յ���Һ��ɫ�ı仯��____________________________��
��4���ζ���������ʾ��
�ζ����� | ������Һ���/mL | ����Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 20 | 1.02 | 21.03 |
2 | 20 | 2.00 | 25.00 |
3 | 20 | 0.60 | 20.60 |
�ζ������ϴ���ǵ�________��ʵ�飬����������Ŀ���ԭ����________��
A. ��ʽ�ζ�����װҺǰδ�ñ�NaOH��Һ��ϴ2��3��
B. �ζ���ʼǰ��ʽ�ζ��ܼ��첿�������ݣ��ڵζ��յ����ʱδ��������
C. �ζ���ʼǰ��ʽ�ζ��ܼ��첿��û�����ݣ��ڵζ��յ����ʱ���ּ��첿��������
D. �ﵽ�ζ��յ�ʱ��������Һ��Һ����͵����
E. �ζ������У���ƿҡ����̫���ң�������ЩҺ�ηɽ�����
��5���������Ũ��Ϊ________mol/L��
��6�����ȷ��ȡ20.00 mL 0.1000 mol/L NaOH��Һ����ƿ�У������ָ̪ʾ����Ȼ����δ֪Ũ�ȵ�����(װ����ʽ�ζ�����)�ζ����Ƿ�Ҳ�ɲⶨ����������ʵ���Ũ�ȣ�________(��ǡ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��ת�����л���ʵ��̼ѭ�������ݻ�Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2��һ�������·�����Ӧ��CO2��g����3H2��g��=CH3OH��g����H2O��g�������CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
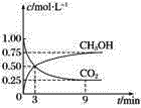
��1����3 min��9 min��v��H2����________ mol��L��1��min��1��
��2����˵��������Ӧ�ﵽƽ��״̬����________������ĸ����
A ��Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1��1����ͼ�н���㣩
B ���������ܶȲ���ʱ��ı仯���仯
C ��λʱ��������3 mol H2��ͬʱ����1 mol H2O
D CO2����������ڻ�������б��ֲ���
��3��һ���¶��£���9 minʱv����CH3OH��________��������������С������������������3 minʱv����CH3OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ԭ���ԭ����ʵ��ʱ��������ʵ�鲽��:
���õ��߽����������Ƶ����˷ֱ��봿����пƬ��ͭƬ������(��ͼ1);
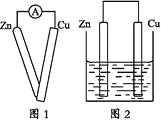
����һ�鴿����пƬ����ʢ��ϡ������ձ���;
����һ�鴿����ͭƬ����ʢ��ϡ������ձ���;
���õ��߰�пƬ��ͭƬ������������ƽ�еز���ʢ��ϡ������ձ���(��ͼ2)��
�ش���������:
(1)ʵ�鲽������Ӧ�۲쵽��������_______________________��
(2)ʵ�鲽������Ӧ�۲쵽��������_______________________��
(3)ʵ�鲽������Ӧ�۲쵽��������_______________________��
(4)ʵ�鲽������Ӧ�۲쵽��������_______________________��
(5)ͨ��ʵ�鲽������ͬѧͷ��������һ������(�����)���ò�����_______��
(6)Ϊ��֤ʵ�ò��룬��ͬѧ������˵�����ʵ�飬���Ҫ����������ʵ���װ��ʾ��ͼ��______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ�������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư��(����һ�����ȷ�Ӧ)����ش��������⣺

��1��AΪʵ�����������ķ���װ�ã���Ӧ��ѧ����ʽΪ_________________________��ijѧ����12 mol��L��1��Ũ����100 mL��������MnO2��Ӧ��Cl2��ʵ�ʵõ���Cl2________6.72 L(����<������>����������)��
��2��Ư�۽���U�ι��в������仯ѧ����ʽ��_________________________________��
��3����ʵ������Ư�۵���Ч�ɷ�ƫ�͡���ѧ�����������������Ϸ��֣���Ҫԭ������U�ι��л�������������Ӧ��
���¶Ƚϸ�ʱ��������ʯ�ҷ�Ӧ����Ca(ClO3)2��Ϊ����˸���Ӧ�ķ������ɲ�ȡ�Ĵ�ʩ��________________��
��Cl2�к�HCl���ᷢ����Ӧ2HCl��Ca(OH)2===CaCl2��2H2O��Ϊ����˸���Ӧ�ķ������ɽ�װ�����θĽ�______________________________��
��4�� Cװ�õ�������________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�к��е�������ΪH+��Na+��Mg2+��Al3+��Ba2+�е�һ�ֻ��֣������Һ�л����ص���NaOH��Һֱ���������������������������NaOH��Һ������Ĺ�ϵ��ͼ��ʾ���ɴ�ȷ��ԭ��Һ��һ�����е���������

A. Mg2+��Al3+��Na+ B. H+��Mg2+��Al3+ C. H+��Ba2+��Al3+ D. Ba2+��Mg2+��Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ��������������ú��ˮ��ԭ�Ͼ��ಽ��Ӧ�Ƶã����е�һ����ӦΪ��CO(g)��H2O(g) ![]() CO2(g)��H2(g) ��H<0����Ӧ�ﵽƽ���Ϊ���CO��ת���ʣ����д�ʩ����ȷ����( )
CO2(g)��H2(g) ��H<0����Ӧ�ﵽƽ���Ϊ���CO��ת���ʣ����д�ʩ����ȷ����( )
A.����CO��Ũ��B.�����¶�C.�����¶�D.����ѹǿ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com