
NA为阿伏加德罗常数,下列叙述正确的是( )
|
| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L |
|
| B. | 31g白磷分子中,含有的共价单键数目是NA个 |
|
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 |
|
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
考点:
阿伏加德罗常数.
分析:
A.氩气是单原子分子;
B.根据白磷分子的结构,采用均摊法计算出31g白磷含有的共价键数目;
C.根据金刚石的结构,采用均摊法计算出6g金刚石含有的共价键数目;
D.计算出二氧化硅的物质的量,根据1mol硅原子形成了4mol硅氧键分析.
解答:
解:A.氩气是单原子分子,标准状况下,含NA个氩原子的氩气的体积约为22.4L,故A错误;
B.31g白磷的含有 =1mol磷原子,白磷为正四面体结构,1个磷原子与其它3个P形成3个P﹣P共价键,根据均摊法,每个磷原子形成的共价键为:
=1mol磷原子,白磷为正四面体结构,1个磷原子与其它3个P形成3个P﹣P共价键,根据均摊法,每个磷原子形成的共价键为: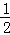 ×3=1.5,所以1molP可以形成1.5mol共价键,含有的共价单键数目是1.5NA个,故B错误;
×3=1.5,所以1molP可以形成1.5mol共价键,含有的共价单键数目是1.5NA个,故B错误;
C.6g金刚石含有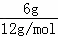 =0.5mol碳原子,1个碳原子与其它4个C形成4个C﹣C共价键,根据均摊法,每个碳原子形成的共价键为:
=0.5mol碳原子,1个碳原子与其它4个C形成4个C﹣C共价键,根据均摊法,每个碳原子形成的共价键为: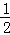 ×4=2,所以0.5mol金刚石可以形成0.5mol×2=1mol共价键,含有的碳碳键数目是6.02×1023,故C错误;
×4=2,所以0.5mol金刚石可以形成0.5mol×2=1mol共价键,含有的碳碳键数目是6.02×1023,故C错误;
D.4.5g二氧化硅的物质的量为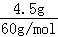 =0.075mol,含有0.075mol硅原子,形成了0.075mol×4=0.3mol硅氧键,含有0.3×6.02×1023个Si﹣O键,故D正确;
=0.075mol,含有0.075mol硅原子,形成了0.075mol×4=0.3mol硅氧键,含有0.3×6.02×1023个Si﹣O键,故D正确;
故选D.
点评:
本题考查阿伏伽德罗常数的相关计算,难度中等.要注意氩气是单原子分子.


科目:高中化学 来源: 题型:
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可加热)( )
|
| A. | BaCl2 | B. | NaOH | C. | Ba(OH)2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )
|
| A. | 锌作阳极,镀件作阴极,溶液中含有锌离子 |
|
| B. | 铂作阴极,镀件作阳极,溶液中含有锌离子 |
|
| C. | 铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
|
| D. | 锌用阴极,镀件作阳极,溶液中含有锌离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各基态原子或离子的电子排布式正确的是( )
|
| A. | O2﹣1s22s22p4 | B. | Ca[Ar]3d2 |
|
| C. | Fe[Ar]3d54s3 | D. | Si 1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
|
| A. | SO2和SiO2 | B. | NaCl和HCl | C. | CCl4和KCl | D. | CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是( )
|
| A. | 根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
|
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
|
| C. | 晶体中一定存在化学键 |
|
| D. | 正四面体分子中键角只能是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为 ;B和N相比,电负性较大的是 ,BN中B元素的化合价为 ;
(2)在BF3分子中,F﹣B﹣F的键角是 ,B原子的杂化轨道类型为,BF3和过量NaF作用可生成NaBF4,BF4﹣的立体结构为 ;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 ,层间作用力为 ;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g•cm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com