
| 编号 | 反应物 | 催化剂 | 温度 |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol/LFeCl3溶液 | 40℃ |
| A. | 实验④反应速率最快 | |
| B. | 实验①反应速率最慢 | |
| C. | 实验②速率小于实验④的速率,只是因为实验④加入了催化剂 | |
| D. | 加入催化剂,能增大活化分子百分数,从而加快化学反应速率 |
分析 A、采取控制变量法分析,浓度越大、温度越高、使用催化剂反应速率越快;
B、采取控制变量法分析,浓度越大、温度越高、使用催化剂反应速率越快;
C、由表中数据可知,实验②、④的不同之处是④中使用催化剂、温度比实验②中高;
D、催化剂降低反应的活化能,增大活化分子百分数,从而加快化学反应速率.
解答 解:A、由表中数据可知,实验④中浓度最高、温度最高且使用催化剂,故反应速率最快,故A正确;
B、由表中数据可知,实验①中浓度最低、温度最低且没有使用催化剂,故反应速率最慢,故B正确;
C、由表中数据可知,实验②、④的不同之处是④中使用催化剂、温度比实验②中高,故实验②速率小于实验④的原因有催化剂、温度的影响,故C错误;
D、催化剂降低反应的活化能,增大活化分子百分数,从而加快化学反应速率,故D正确.
故选C.
点评 本题考查影响化学反应速率的因素、数据分析处理等,难度中等,注意控制变量法的运用.


科目:高中化学 来源: 题型:解答题
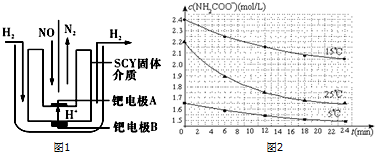
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
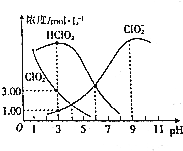 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | HClO2的电离平衡常数Ka=10-6 | |
| C. | pH=3时,c(Cl-)>c(ClO2-) | |
| D. | pH=4时,c(Cl-)+c(ClO2-)-c(Na+)=10-4-10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 12 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 | 0 |
| A. | b对应元素的最高价氧化物的水化物的碱性比e强 | |
| B. | d的水溶液显碱性 | |
| C. | H具有可燃性 | |
| D. | e相应的元素的单质与g微粒任何条件下都不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
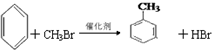 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.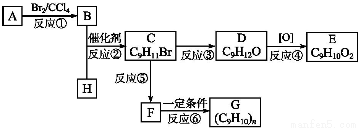
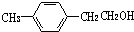 ,F的分子式C9H10.
,F的分子式C9H10.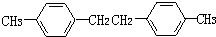 .
.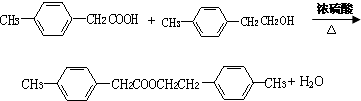 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的中子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉碘化钾在空气中变蓝:2I-+O2+4H+═2H2O+I2 | |
| B. | Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32-+Ca2+=CaCO3↓ | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2=2CO2+2CaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com