
| A. | ①②③④ | B. | ③④②① | C. | ①②③④ | D. | ③④①② |
分析 先根据影响水的电离平衡的因素分析,酸和碱抑制水的电离,能水解的盐促进水的电离;水溶液中一定温度下存在氢氧根离子浓度和氢离子浓度乘积是常数,存在水的离子积;可以计算溶液中水电离出的氢离子或氢氧根离子进行比较.
解答 解:①pH=0的盐酸c(H+)酸=1mol/L,抑制水的电离,水电离出的氢离子浓度等于水电离出的氢氧根离子浓度,由水溶液中的离子积计算:c(H+)酸c(OH-)水=10-14,c(OH-)水=c(H+)水=10-14mol/L;
②0.5mol•L-1盐酸溶液中c(H+)酸=0.5mol/L,抑制水的电离,所以根据水溶液中的离子积计算:c(H+)酸COH-)水=10-14,c(OH-)水=c(H+)水=2×10-14mol/L;
③pH=4的NH4Cl溶液中,NH4++H2O?NH3•H2O+H+;促进水的电离,水电离出的氢离子增大,溶液中所有的氢离子和氢氧根均来自于水的电离,故水电离出的氢离子的浓度为c(OH-)水=c(H+)水=10-4mol/L;
④0.1mol•L-1的NaOH溶液中c(OH-)碱=0.1mol/L,根据水溶液中的离子积计算:c(H+)水c(OH-)碱=10-14,c(OH-)水=c(H+)水=10-13mol/L:
综上所述:溶液中水电离的c(H+)由大到小的顺序是③④②①.
故选B.
点评 本题考查了水的电离平衡的影响因素,水溶液中离子积的应用,主要是水解的盐对水的电离的影响判断,③⑤的比较是关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Z的电子式为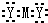 | B. | Z可表示为M2Y | C. | Z一定溶于水中 | D. | M形成+2价阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将铁片放入浓硫酸中 | 无明显现象 | 铁片发生了钝化 |
| B | 将SO2通入Na2CO3溶液中,将产生的气体再通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明酸性: H2SO3>H2CO3>H2SiO3 |
| C | 向含有Fe3+的溶液中滴加KSCN溶液 | 溶液变红色 | 有Fe(SCN)3生成 |
| D | 向KOH溶液中滴加FeCl3溶液 | 有红褐色沉淀生成 | OH-+Fe3+=Fe(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
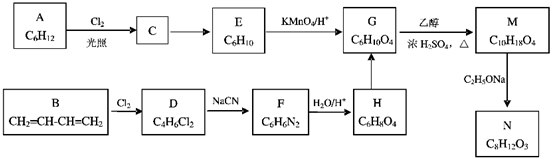
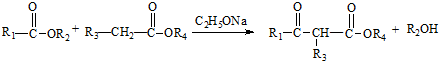
 .
.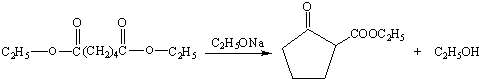 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
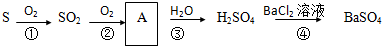
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子多 | |
| C. | 1 mol A从酸中置换出H2比1 mol B多 | |
| D. | 常温下,A能从酸中置换出氢气,而B不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 | |
| B. | 在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的是H2O | |
| C. | 第二周期元素的最高正化合价都等于其原子的最外层电子数 | |
| D. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
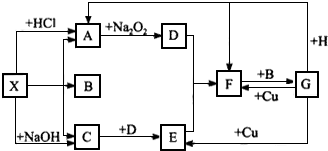
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com