
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是_____。
A.质谱法 B.原子发射光谱法 C.核磁共振谱法 D.X射线行射法
(2)基态As原子的核外电子排布式为_____,As原子的逐级电离能数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
为什么第五电离能与第六电离能相差较大_____。
(3)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为_____,层与层之间的相互作用为_____。

(4)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为_____,每个As原子周围最近的As原子数目为_____,与同一个Ga原子距离最近的As原子构成的空间构型为_____,一个GaAs晶胞中配位键的数目为_____。

(5)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为_____ nm(列式表示)。
【答案】D [Ar]3d104s24p3 As原子最外层有五个电子,失去的第六个电子来自全满的次外层,所需能量较高 sp3 范德华力 原子晶体 12 正四面体 4  ×107
×107
【解析】
(1)判断晶体、非晶体最科学的方法是X-射线衍射实验;
(2)基态As原子核外有33个电子,根据构造原理书写基态As原子的核外电子排布式;As的第五电离能与第六电离能相差显著,As失去5个电子后电子排布为[Ar]3d10,此时3d为全满,较稳定;
(3)黑磷中P原子的价层电子对数是4且含有一对孤电子对,根据价层电子对互斥理论判断P原子杂化形式,层与层之间的相互作用为范德华力;
(4)根据GaAs的熔点和熔融状态不导电分析判断晶体的类型;根据晶胞结构图,As原子位于晶胞的顶点和面心,判断每个As原子周围最近的As原子数目;Ga原子最外层有3个电子,As原子最外层有5个电子,该晶胞中每个Ga原子和4个As原子形成化学键,其中一个为配位键,据此判断一个CaAs晶胞中配位键的数目;
(5)根据均摊法计算该晶胞中As和Ga的原子个数是4,再结合晶胞中最近的As和Ga原子核间距等于晶胞体对角线长度的![]() 计算。
计算。
(1)判断晶体、非晶体最科学的方法是X-射线衍射实验,所以能证明红磷是非晶体的是X-射线衍射实验,故选D;
(2)基态As原子核外有33个电子,根据构造原理,基态As原子的核外电子排布式为[Ar]3d104s24p3;As的第五电离能与第六电离能相差显著,是因为As失去5个电子后电子排布为[Ar]3d10,此时3d为全满,较稳定,此时再失去一个电子较困难,所以第五电离能与第六电离能相差显著,故答案为:[Ar]3d104s24p3;As原子最外层有五个电子,失去的第六个电子来自全满的次外层,所需能量较高;
(3)黑磷中P原子的价层电子对数是4且含有一对孤电子对,根据价层电子对互斥理论,P原子杂化形式为sp3,层与层之间的相互作用为范德华力,故答案为:sp3;范德华力;
(4)GaAs的熔点为1238℃,且熔融状态不导电,符合原子晶体的特征,GaAs为原子晶体;根据晶胞结构图,As原子位于晶胞的顶点和面心,每个As原子周围最近的As原子数目为12个;与同一个Ga原子距离最近的4个As原子构成正四面体;Ga原子最外层有3个电子,As原子最外层有5个电子,该晶胞中每个Ga原子和4个As原子形成化学键,其中一个为配位键,Ga原子位于晶胞内部,Ga原子个数是4,则一个CaAs晶胞中配位键的数目为4,故答案为:原子晶体;12;正四面体;4;
(5)该晶胞中As原子位于晶胞的顶点和面心,As原子个数=8×![]() +6×
+6×![]() =4、Ga原子位于晶胞内部,Ga原子个数是4,晶胞的质量=
=4、Ga原子位于晶胞内部,Ga原子个数是4,晶胞的质量=![]() g,则晶胞棱长=
g,则晶胞棱长=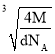 cm=
cm=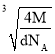 ×107 nm。晶胞中最近的As和Ga原子核间距等于晶胞体对角线长度的
×107 nm。晶胞中最近的As和Ga原子核间距等于晶胞体对角线长度的![]() ,晶胞中最近的As和Ga原子核间距=
,晶胞中最近的As和Ga原子核间距=![]() ×
×![]() ×
×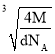 ×107 nm=
×107 nm=![]() ×
×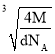 ×107n,故答案为:
×107n,故答案为:![]() ×
×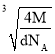 ×107。
×107。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾。
(1)SO2Cl2水解的方程式为_______________________________________________
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g)![]() SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
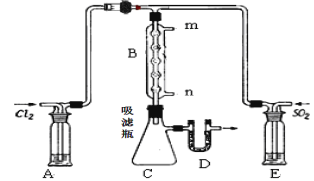
①E中所用的试剂为________________
②实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是____(选填编号);检查该装置气密性的操作是:关闭止水夹,再___________________________________

③B处反应管内五球中玻璃棉上的活性炭的作用为:_______________________D处U形管中盛放的试剂为_________________,作用 :________________________
(3)已知:以下三个反应的反应热,a、b、c均为正值
①SO2(g)+Cl2(g)+SCl2(g) ![]() 2SOCl2(g) △H=-akJ·mol-1
2SOCl2(g) △H=-akJ·mol-1
②SO2Cl2(g)+SCl2(g) ![]() 2SOCl2(g) △H=-bkJ·mol-1
2SOCl2(g) △H=-bkJ·mol-1
③SO2Cl2(l) ![]() SO2Cl2(g) △H= + ckJ·mol-1
SO2Cl2(g) △H= + ckJ·mol-1
则反应:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.![]() B.
B.![]() C.
C.![]() D.CH2 = CH—CH = CH2E.环戊烷
D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)用系统命名法对B进行命名____________________________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B发生加聚反应的化学方程式为 ____________________________________。
(5)如图表示的是一种叫做双烯合成的有机反应,请写出B与D发生双烯合成所得产物的结构简式__________________。
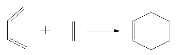
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 1.0molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___________。

(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_____(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(填“增加”“减少”或“不变”);所求中和热数值_____(填“增加”“减少”或“不变”)。
(4)_____(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2﹣t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 gcm﹣3,中和后混合液的比热容c=4.184×10﹣3kJg﹣1℃﹣1则该反应的中和热为△H=_____(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJmol﹣1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差 b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的叙述正确的是( )
A.丙烷的二卤代物是4种,则其六卤代物是2种
B.某烃的同分异构体只能形成一种一氯代物,其分子式一定为C5H12
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.对二甲苯的核磁共振氢谱显示有3种不同化学环境的氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是______,发生反应的离子方程式为______,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是______,发生反应的离子方程式为______,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为______
的溶液为______![]()
![]() 已知常温下
已知常温下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
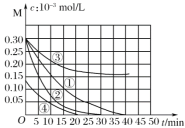
实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含有下列离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的四种
中的四种![]() 忽略水的电离及盐的水解
忽略水的电离及盐的水解![]() ,且各离子的物质的量浓度相等,现进行如下实验:
,且各离子的物质的量浓度相等,现进行如下实验:
![]() 取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其他明显现象;
取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其他明显现象;
![]() 取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成。
取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成。
根据上述实验,下列说法正确的是
A.根据实验![]() 只能确定原溶液中一定有
只能确定原溶液中一定有![]() ,没有
,没有![]()
B.取实验![]() 后的溶液滴加淀粉,溶液变蓝色
后的溶液滴加淀粉,溶液变蓝色
C.原溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子
四种离子
D.取少量原溶液加酸性高锰酸钾溶液,有两种离子被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )

A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为MgBr2(s)+Cl2(g)===MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com