
| A. | 两种气体质量相等 | B. | 两种气体的物质的量之比为16:1 | ||
| C. | 两种气体压强比为16:1 | D. | 两种气体体积比为1:16 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 事实 | 推论 |
| A | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| B | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,Br2+H2?2HBr K=5.6×107 I2+H2?2HI K=43 | 非金属性:Br>I |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
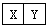 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存, .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族.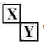 ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧结粘土制陶瓷涉及化学变化 | |
| B. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | C2H4(g) | H2O(g) | C2H5OH(g) |
| 物质的量分数 | 0.25 | 0.25 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 在氢氧化钡溶液中逐滴加入硫酸氢钠溶液至恰好呈中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H-+H2O2═Fe3++2H2O | |
| D. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com