
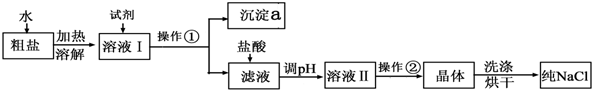

分析 (1)粗盐提纯步骤为:溶解→过滤→蒸发结晶;操作②为蒸发结晶,该装置中仪器a为蒸发皿;
(2)根据根据Mg2+、Ca 2+、SO42-等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的盐酸溶液,沉淀a为氢氧化镁、碳酸钙、硫酸钡,硫酸钡不溶于盐酸;
(3)硫酸根离子与钡离子反应生成硫酸钡白色沉淀,而且这种白色沉淀不溶于水也不溶于酸,所以一般用可溶性钡盐来检验硫酸根离子的存在;
(4)除去硫酸根离子用氯化钡,因硫酸钡不溶于水,也不溶于酸,一般用氯化钡溶液检验,因加钡离子过量,所以或用硫酸钠检验SO42-已沉淀完全,可静置片刻后,取上层清液于试管中,继续滴入BaCl2溶液或取上层清液,继续滴入Na2SO4溶液.
解答 解:(1)粗盐中含有泥沙,故应该先溶解然后再过滤而得到澄清溶液,最后蒸发结晶即可,所以步骤①的操作名称是过滤,操作②为蒸发结晶,需蒸发皿等蒸发装置,应选取装置D,该装置中仪器a的名称是蒸发皿,
故答案为:过滤; D; 蒸发皿;
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,Mg2++2OH-=Mg(OH)2↓;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,Ba2++SO42-=BaSO4↓;至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,Ca2++CO32-=CaCO3↓,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,Ba2++CO32-=BaCO3↓,离子都形成沉淀,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,所以B选项中Na2CO3溶液排在BaCl2溶液之前错误,沉淀a为氢氧化镁、碳酸钙、硫酸钡,硫酸钡不溶于盐酸;
故答案为:B;BaSO4;
(3)检验溶液中是否存在硫酸根离子的简便方法为:取粗盐溶解于水,静置片刻,取上层清液(或取溶液Ⅰ),滴加盐酸后,无明显变化,再滴加一滴BaCl2溶液,如果出现白色浑浊或者沉淀,则说明含SO42-,
故答案为:取粗盐溶解于水,静置片刻,取上层清液(或取溶液Ⅰ)滴加盐酸后无明显变化,再加BaCl2 溶液,若出现白色沉淀或浑浊,则说明含SO42-;
(4)加入过量氯化钡溶液除去硫酸根离子,SO42-+Ba2+=BaSO4↓;检验硫酸根离子已除尽,取上层清液,继续滴入BaCl2溶液,若无白色沉淀,则说明SO42-已沉淀完全(因钡离子过量,或取上层清液,继续滴入Na2SO4溶液,若有白色沉淀,则说明SO42-已沉淀完全),
故答案为:过量的BaCl2 溶液; 取上层清液,继续滴入BaCl2溶液,若无白色沉淀,则说明SO42-已沉淀完全(或取上层清液,继续滴入Na2SO4溶液,若有白色沉淀,则说明SO42-已沉淀完全).
点评 本题主要考查了粗盐提纯实验,为高频考查点,侧重于学生的分析和实验能力的考查,综合性强,要注意除杂质选取和添加的先后顺序,注意相关基础知识的积累,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大压强,平衡向右移动 | B. | 加入催化剂,Z的产率增大 | ||
| C. | 增大c(X),X的转化率增大 | D. | 降低温度,Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
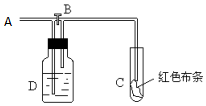 如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )| A. | abc | B. | bcd | C. | abd | D. | abcd |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
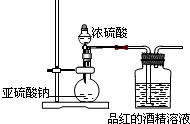
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 浓硫酸是一种重要的化工产品.
浓硫酸是一种重要的化工产品.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
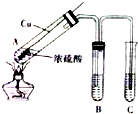
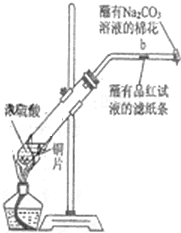 如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:
如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸是一种弱酸是因为次氯酸不稳定,易分解 | |
| B. | 用氯气制漂白粉的主要目的是转变为较稳定,便于贮存的物质 | |
| C. | 漂白粉在空气中容易失效的原因是次氯酸钙易和空气中的水及二氧化碳反应 | |
| D. | 氯原子最外层有7个电子,故在化学反应中易结合一个电子而形成Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com