
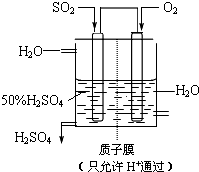
 某人设想以如图所示装置用电化学原理生产硫酸,写入通入SO2的电极的电极反应式
某人设想以如图所示装置用电化学原理生产硫酸,写入通入SO2的电极的电极反应式| 2.24L/min×1min |
| 22.4L/mol |
| 98×0.1 |
| 0.1×64+18x |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| △ |
| A、上述反应中,每生成1molN2则转移电子6mol |
| B、上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C、反应从能量变化上说,主要是化学能转变为热能和动能 |
| D、在反应中高氯酸铵既起氧化剂,又起还原剂作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① | 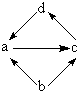 | FeCl2 | Fe | FeCl3 | CuCl2 |
| ② | Na2O | Na | Na2O2 | Mg(OH)2 | |
| ③ | NO | N2 | NO2 | NaCl | |
| ④ | Al2O3 | Al | Na[Al(OH)4] | Al(OH)3 |
| A、①②③ | B、①③④ |
| C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 | ||
| A | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH
| ||
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,在滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红 下层溶液紫色红 实验现象2: 上层溶液变红 | 氧化性:Br2>Fe3+>I2 | ||
| C | 淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 | ||
| D | BaSO4固体加入饱和Na2CO3溶液中,过滤,箱滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)<Ksp(BaSO4) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
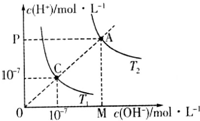
| A、水的离子积常数关系为:C>A |
| B、升高温度可实现由C点到A点 |
| C、T1时,pH=4的硫酸与pH=l0的氢氧化钠溶液等体积混合,所得溶液的pH=7 |
| D、图中矩形OMAP的面积表示T2时水的离子积的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业制H2SO4时,催化氧化阶段的反应原理为2SO2+O2
| ||||
B、海水提镁的主要步骤为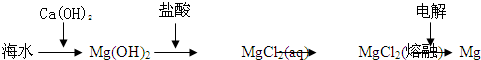 | ||||
C、冶炼铝时电解铝的反应原理为:2AlCl3
| ||||
D、高炉炼铁还原剂还原赤铁矿的化学方程式为:Fe2O3+3CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y的简单离子半径小于Z的简单离子半径 |
| B、Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
| C、Y的简单气态氢化物在一定条件下可被Q单质氧化 |
| D、Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com