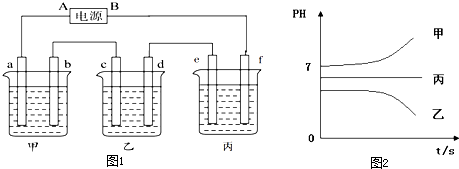
考点:离子化合物的结构特征与性质,电子式,共价键的形成及共价键的主要类型,用电子式表示简单的离子化合物和共价化合物的形成
专题:化学用语专题,化学键与晶体结构
分析:①N2中N原子之间只存在共价键,属于单质;
②Na2O中钠离子和氧离子之间只存在离子键,为离子化合物;
③NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离子化合物;
④CH4中C原子和H原子之间只存在极性共价键,为共价化合物;
⑤CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
⑥MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;
⑦NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
结合电子式的书写特点、物质的性质过程等知识点来分析解答.
解答:
解:①N
2中N原子之间只存在共价键,属于单质;
②Na
2O中钠离子和氧离子之间只存在离子键,为离子化合物;
③NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离子化合物;
④CH
4中C原子和H原子之间只存在极性共价键,为共价化合物;
⑤CO
2中C原子和O原子之间只存在极性共价键,为共价化合物;
⑥MgF
2中镁离子和氟离子之间只存在离子键,为离子化合物;
⑦NH
4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
(1)只由离子键构成的物质是②⑥,故答案为:②⑥;
(2)只由极性键构成的物质是④⑤,故答案为:④⑤;
(3)只由非极性键构成的物质是①,故答案为:①;
(4)只由非金属元素组成的离子化合物是⑦,故答案为:⑦;
(5)②Na
2O的电子式为

,④CH
4的电子式为
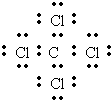
,
故答案为:

;

;
(6)二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为:

,氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为

故答案为:

;

.
点评:本题考查了化学键的判断及电子式的书写,根据物质的构成微粒及微粒间的作用力判断化学键,根据电子式的书写规则书写电子式,难点是电子式的书写,题目难度不大.

 ,④CH4的电子式为
,④CH4的电子式为 ,
, ;
; ;
; ,氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为
,氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 故答案为:
故答案为: ;
; .
.


 阅读快车系列答案
阅读快车系列答案