
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 _________________________。
(2)已知H2O(l) H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
___________________________________。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7 kJ·mol-1
2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
肼和二氧化氮反应的热化学方程式为 __________________________。
(1)N2H4(l)+2H2O2(l) N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
(2)408.815
(3)产物不会造成环境污染
(4)N2H4(g)+NO2(g) 3/2N2(g)+2H2O(g) ΔH=-567.9 kJ·mol-1
3/2N2(g)+2H2O(g) ΔH=-567.9 kJ·mol-1
【解析】(1)0.4 mol N2H4反应放热256.652 kJ,则1 mol N2H4反应应放热kJ=641.63 kJ。
(2)16 g N2H4的n(N2H4)==0.5 mol。由方程式知生成n(H2O)=0.5 mol×4=2 mol,则16 g N2H4与H2O2生成H2O(l)放热为641.63 kJ×0.5 mol+2 mol×44 kJ·mol-1=408.815 kJ。
(3)产物为N2(g)和H2O,无污染。
(4)由所提供方程式,利用盖斯定律求解。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2014年高二化学苏教版选修2 1.3海水淡化练习卷(解析版) 题型:填空题
海水资源的利用具有非常广阔的前景。
(1)海水淡化的主要方法有(只写出1种即可)________。
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品。
①用石墨电极电解饱和食盐水时,阴极的电极反应式是
_______________________________________________________________。
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112 mL(已折算为标准状况)时停止电解,此时溶液体积为1 L,若忽略气体的溶解,最终溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 7化学平衡状态的建立及标志练习卷(解析版) 题型:选择题
在恒温下的密闭容器中,有可逆反应:2NO+O2 2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.反应容器中压强不随时间的变化而变化
C.混合气体颜色保持不变
D.混合气体的平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 5化学反应速率练习卷(解析版) 题型:填空题
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是 ________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率: 。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 5化学反应速率练习卷(解析版) 题型:选择题
某温度时,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成的Z的浓度为0.4 mol·L-1,则该反应的化学方程式(Z用X、Y表示)是( )
A.X2+2Y2 2XY2B.2X2+Y2
2XY2B.2X2+Y2 2X2Y
2X2Y
C.X2+3Y2 2XY3D.3X2+Y2
2XY3D.3X2+Y2 2X3Y
2X3Y
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:选择题
根据碘与氢气反应的热化学方程式
(1)I2(g)+H2(g)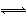 2HI(g) ΔH=-9.48 kJ
2HI(g) ΔH=-9.48 kJ
(2)I2(s)+H2(g) 2HI(g) ΔH=26.48 kJ
2HI(g) ΔH=26.48 kJ
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(1)的产物比反应(2)的产物稳定
D.反应(2)的反应物总能量比反应(1)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 3燃烧热 能源练习卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g) CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
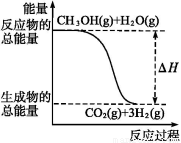
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+O2(g) CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 2中和反应反应热的测定练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.中和热一定是强酸跟强碱反应放出的热量
B.1 mol酸与1 mol 碱完全反应放出的热量是中和热
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热
D.测定中和热时可用稀硫酸和稀Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 19一次电池 二次电池练习卷(解析版) 题型:选择题
已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用稀硫酸作电解质溶液。在放电时,两极发生的反应可分别表示为:
Pb+S-2e- PbSO4
PbSO4
PbO2+4H++S+2e- PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e- Pb+S
Pb+S
PbSO4+2H2O-2e- PbO2+4H++S
PbO2+4H++S
则在放电时,下列说法中正确的是( )
A.充满海绵状灰铅的铅板为电源正极
B.充满二氧化铅的铅板为电源负极
C.铅板在放电时发生氧化反应
D.铅板在放电时发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com