
| A. | 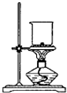 钾的燃烧实验 | B. | 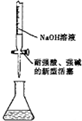 用强碱滴定强酸 | ||
| C. | 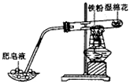 铁与H2O(g)反应 | D. | 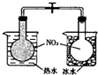 探究温度对平衡移动的影响 |
分析 A.灼烧固体用坩埚;
B.耐强酸强碱的滴定管可盛放氢氧化钠;
C.湿棉花可产生水蒸气;
D.已知2NO2?N2O4△H<0,根据颜色的变化判断.
解答 解:A.灼烧固体用坩埚,不能用烧杯,故A错误;
B.耐强酸强碱的滴定管可盛放氢氧化钠溶液,故B正确;
C.湿棉花可产生水蒸气,肥皂泡可检验氢气,故C正确;
D.已知2NO2?N2O4△H<0,根据颜色的变化可知平衡移动的方向,以此可确定温度对平衡移动的影响,故D正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及常见仪器的使用、铁与水反应与温度对平衡移动的影响的探究等,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
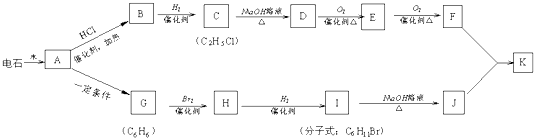
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.
、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.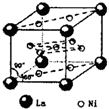 ,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.
,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 方法d是最为节能的一种方法 | |
| B. | 方法a~d中,H2O分子中的共价键全部断裂 | |
| C. | H2O、H2O2所含的化学键类型完全相同 | |
| D. | H2O是共价化合物,CH4是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
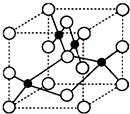 (1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形.
(1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
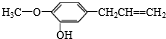 下列有关佳味备醇的说法中不正确的是( )
下列有关佳味备醇的说法中不正确的是( )| A. | 佳味备醇含有一个苯环,它是一种芳香族化合物 | |
| B. | 佳味备醇可以与溴水发生加成和取代反应,还能与氯化铁溶液发生显色反应 | |
| C. | 佳味备醇分子中至少有十二个原子在同一平面上 | |
| D. | 1mol佳味备醇分别与氢气、溴水反应时,最多消耗4molH2,4molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
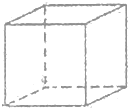 已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.
已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.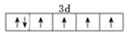 ;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.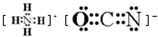 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 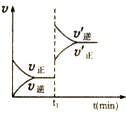 表示某吸热反应t1时刻升高温度时,正逆反应速率的变: | |
| B. | 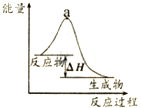 表示某放热反应过程的能量变化,若使用催化剂,a点会降低 | |
| C. | 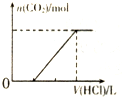 表示向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 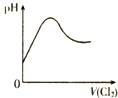 表示Cl2通入H2SO3溶液中pH的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com