
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡: ![]() ,
,![]() 。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
A. 若![]() ,则该反应达到平衡状态
,则该反应达到平衡状态
B. 两次平衡时,后一次平衡时![]() 的浓度大
的浓度大
C. 重新达到平衡,密闭容器中氨气的体积分数不变
D. 若开始时向容器中加人2molNH3和1molCO2,则达到平衡时放出akJ热量
科目:高中化学 来源: 题型:
【题目】那可汀是一种药物,该药适用于刺激性干咳病人服用,无成瘾性。化合物I是制备该药物的重要中间体,合成路线如下:

(1)化合物A中的官能团名称为________________(写两种)。
(2)设计反应A→B的目的为________________________________。
(3)化合物C的分子式为C10H11O4I,写出C的结构简式:________________________。
(4)化合物I的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________________。
①分子中含有硝基(—NO2)且直接连在苯环上;②分子中只有3种不同化学环境的氢。
(5)写出以 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的电极材料和电解液,不能组成原电池的是( )
A. 铜片、石墨棒,蔗糖溶液B. 锌片、石墨棒,硫酸铜溶液
C. 锌片、铜片,稀盐酸D. 铜片、银片,硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________molH2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(5)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为___________mol。
②该气体所含原子总数为___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是

A. 复分解反应、复分解反应、化合反应、置换反应
B. 中和反应、置换反应、复分解反应、置换反应
C. 复分解反应、复分解反应、置换反应、置换反应
D. 分解反应、复分解反应、置换反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是
①化学键只存在于分子之间
②化学键是相邻原子之间强烈的相互作用
③化学键是一种静电作用
④化学键是相邻分子之间强烈的相互吸引
⑤离子化合物中可能含有共价键
⑥共价化合物中可能含有离子键
⑦离子化合物中只含离子键
⑧共价化合物中不含离子键
A.②③④⑦B.②③⑤⑧
C.②④⑤⑥D.①③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为使桥体更牢固,港珠澳大桥采用高性能绳索吊起,该绳索是超高分子量的聚乙烯材料,同时也使用了另一种叫芳纶(分子结构下图所示)的高性能材料,以下对这两种材料的说法错误的是
![]()
A. 芳纶是一种混合物
B. 聚乙烯能使溴水褪色
C. 聚乙烯和芳纶的废弃物在自然环境中降解速率慢,会造成环境压力
D. 合成芳纶的反应方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇在工业中有广阔的用途
已知:①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ·mol-1
(1)反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)的△H=___________。
(2)CH3OH不充分燃烧时,生成C、CO和CO2以及气态水,将所有的产物通入一个10L的密闭容器中,在一定条件下发生可逆反应:
CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①有利于提高CO平衡转化率的条件是___________。(填正确答案标号)
A.高温 B.低温 C.低压 D.高压
②下列事实能说明该反应达到平衡的是___________。(填正确答案标号)
A.体系中的颜色不发生变化 B. v正(CO)/v逆(H2)=1
C.c(CO)/c(H2)=1 D.CO2的浓度不再发生变化
③向该密闭容器中充入2 mol CO,4.8molH2O。在200℃下,20分钟后达到平衡,测得CO的转化率为60%,v(CO2)=___________;该温度下的平衡常数是___________。
(3)在加热条件下用甲醇气相法制备CO和H2时,常采用加NiO作催化剂。发生2CH3OH(l)![]() 2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
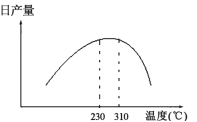
①保证较高日产量的适宜温度是______________;
②310℃以后日产量下降的原因可能是___________。
(4)21世纪甲醇燃料电池是最佳动力源之一。甲醇空气电池成为了车载电池,该燃料电池工作时的电池反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)。原理如图
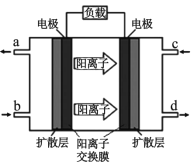
①c处应通入_________________________________;
②该电池的负极反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+2D(g)中,表示该反应速率最快的是( )
3C(g)+2D(g)中,表示该反应速率最快的是( )
A. υ(A)=0.5 mol/(L·s) B. υ(B)=0.3 mol/(L·s)
C. υ(C)=0.8 mol/(L·s) D. υ(D)=1 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com