
| A. | 聚丙烯的结构简式为: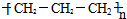 | |
| B. | 已知:正丁烷(C4H10)的二氯代物有六种同分异构体,则它的八氯代物也有六种同分异构体 | |
| C. | 四氯化碳分子的电子式为: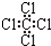 | |
| D. | 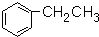 有7种吸收峰 有7种吸收峰 |
分析 A、聚丙烯分子中的结构单元为-CH2-CH2(CH3)-;
B、采用换元法,将氯原子代替氢原子,氢原子代替氯原子,从二氯代物有6种同分异构体,就可得到八氯代物也有6种同分异构体;
C、氯原子的最外层含有3对孤对电子没有标出;
D、有多少种氢就有多少组吸收峰.
解答 解:A、聚丙烯的结构简式为: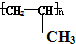 ,故A错误;
,故A错误;
B、丁正烷有10个H原子,其中2个H原子被氯原子取代形成正丁烷的二氯代物,其八氯代物的同分异构可以看作C4Cl10中的10个氯原子,其中2个氯原子被2个氢原子代替形成,两者是等效的,二氯代物有6种同分异构体,可得到八氯代物也有6种同分异构体,故B正确;
C、氯原子未成键的孤对电子对未画出,四氯化碳是共价化合物,碳原子与氯原子之间形成1对共用电子对,电子式为 ,故C错误;
,故C错误;
D、由结构的对称性可知,苯环上有3种H,侧链上有2种氢,共有5种位置的H,则该有机物核磁共振氢谱有5种类型氢原子的吸收峰,故D错误;
故选B.
点评 本题考查有机物的组成和结构,能书写结构简式、同分异构体、电子式,本题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24L氯气与水反应,转移的电子数为0.2NA | |
| B. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| C. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| D. | 标准状况下,11.2L三氧化硫所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
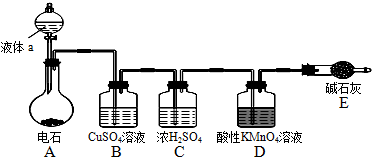
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
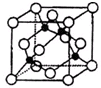 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
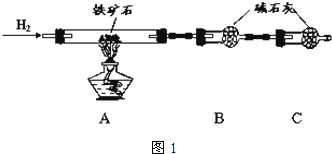 铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.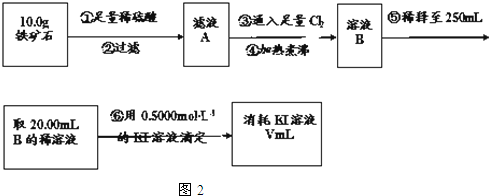
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HI | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 酸性:HClO4>H2SO4. | D. | 离子半径:N3->O2->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数 | B. | 中子数 | C. | 质量数 | D. | 电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
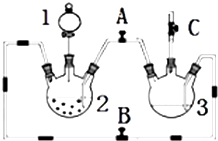 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com