
分析 CO32-与Fe3+、Cu2+、Ba2+、Al3+不能大量共存,OH-与Fe3+、Cu2+、Al3+不能大量共存,则必有的两种物质记为甲、乙,甲、乙分别为K2CO3、Ba(OH)2,丙与甲的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,蓝色沉淀为氢氧化铜,白色沉淀为硫酸钡,则甲应为Ba(OH)2,丙中含SO42-,则丙为CuSO4,由Cu投入装有足量丁溶液的试管中,Cu不溶解,再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现,戊溶液与氢碘酸反应时可生成棕色物质,丁为Al(NO3)3,戊为FeCl3,以此来解答.
解答 解:CO32-与Fe3+、Cu2+、Ba2+、Al3+不能大量共存,OH-与Fe3+、Cu2+、Al3+不能大量共存,则必有的两种物质记为甲、乙,甲、乙分别为K2CO3、Ba(OH)2,丙与甲的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,蓝色沉淀为氢氧化铜,白色沉淀为硫酸钡,则甲应为Ba(OH)2,丙中含SO42-,则丙为CuSO4,由Cu投入装有足量丁溶液的试管中,Cu不溶解,再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现,戊溶液与氢碘酸反应时可生成棕色物质,丁为Al(NO3)3,戊为FeCl3,
(1)由上述分析可知,必有的两种物质为K2CO3、Ba(OH)2,故答案为:K2CO3;Ba(OH)2;
(2)丙与甲的溶液混合时产生蓝色沉淀,说明丙中含Cu2+,加足量稀硝酸沉淀部分溶解,说明甲中含Ba(OH)2,丙中含SO42-,即丙为CuSO4,故答案为:CuSO4;
(3)红棕色气体,为NO与空气中的氧气反应生成的NO2,丁中含有NO3-,已知将19.2gCu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,
发生的反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
则n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,
由方程可知$\frac{3}{8}$=$\frac{0.3mol}{n({H}^{+})}$,
所以n(H+)=0.8mol,
所以n(H2SO4)=12n(H+)=0.4mol,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;0.4mol;
(4)戊中加氢碘酸,生成棕色物质为I2,说明戊中含氧化性离子,只能是Fe3+,离子反应为2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和推断能力的考查,把握物质的性质、离子之间的反应与现象为解答的关键,注意硝酸盐的性质为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | I-是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2既被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个N2分子和NA个CO分子的质量之比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对分子质量之和 | |
| C. | 分别由NA个水分子组成的水、冰、水蒸气的质量各不相同 | |
| D. | 1 mol N2的质量等于NA个氮原子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液、稀盐酸 | B. | NaCl溶液、KNO3溶液 | ||
| C. | Na2CO3溶液、澄清石灰水 | D. | Na2CO3溶液、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
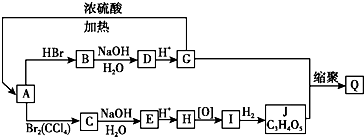
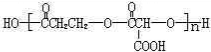 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 |
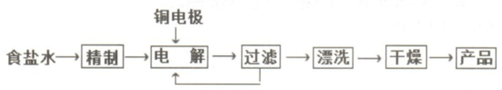
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22g2H218O中含有的质子数为10NA | |
| B. | 电解58.5g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com