
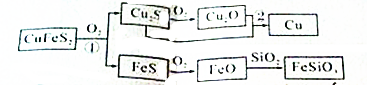
| ||
| ||
| ||
| ||
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| 2 |
| 3 |
| ||


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
下列各对物质中,互为同系物的是
A.CH4、C2H4 B.CH4、C2H5OH
C.C2H6、C3H8 D.CH3COOH、C3H8
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:填空题
(18分)(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各项中的两个量,其比值一定为2:1的是
A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体
B.在碳与浓硫酸的反应中,还原产物与氧化产物的物质的量
C.1mol Na2O2与1molNa2O中的阴离子数目
D.相同温度下,0.2mol/L醋酸溶液和0.1mol/L醋酸溶液中c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
| ② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, | |
| 步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X可能含有2种盐 |
| B、Y可能含有(NH4)2SO4 |
| C、a是SO3 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A、Z的氧化物可与Y的氢化物水溶液发生化学反应 |
| B、X的原子半径比As原子半径小,两者原子序数之差为29 |
| C、W的氧化物对应的水化物是共价化合物,并且必是强酸 |
| D、图中五种元素均是非金属元素,并且Y的非金属性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉和纤维素均为高分子化合物,两者都是工业制造酒精的原料 |
| B、CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 |
| C、等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减少 |
D、已知苹果酸的结构简式为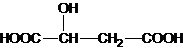 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com