
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
(1)当A中压力过大时,安全管中液面上升,使A瓶中压力稳定
(2)碱 酚酞(或甲基红)
(3)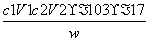 ×100%
×100%
(4)偏低
(5)防止硝酸银见光分解 2.8×10-3
(6)+3 2CoCl2+2NH4Cl+10NH3+H2O2===2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
[解析] (1)安全管与大气相通,可通过液体在安全管的上升平衡A瓶内的压强。(2)量取NaOH溶液用碱式滴定管,滴定终点由酸性变到中性,用酚酞作指示剂。(3)根据题给信息可知HCl参与两个反应:氨测定过程中反应为NH3+HCl===NH4Cl,残留HCl与NaOH反应。由氨测定过程中反应的HCl的量可确定氨的量,进而确定氨的质量分数。(4)若气密性不好则会导致氨气逸出,使测量结果偏低。(5)测氯的过程中用硝酸银溶液,而硝酸银见光易分解,故用棕色滴定管;根据溶度积常数和c(Ag+)可计算出c(CrO )。(6)由样品中钴、氨、氯的物质的量之比为1∶6∶3得X的化学式[Co(NH3)6]Cl3,利用化合价规则判断钴的化合价;制备X时用到H2O2,而H2O2在温度过高时会分解,且温度过高溶解的氨也会减小。
)。(6)由样品中钴、氨、氯的物质的量之比为1∶6∶3得X的化学式[Co(NH3)6]Cl3,利用化合价规则判断钴的化合价;制备X时用到H2O2,而H2O2在温度过高时会分解,且温度过高溶解的氨也会减小。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为__________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:_____________________________________________________,并设计实验方案验证该反应的产物:__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3===Na++H++CO
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO )+c(CO
)+c(CO )
)
D. 温度升高,c(HCO )增大
)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。

(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是( )
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合:
c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):
c(NH3·H2O)>c(NH )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:
 c(Na+)=c(CO
c(Na+)=c(CO )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O )+c(HC2O
)+c(HC2O )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
| 0.01 mol·L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(1)X、W的化学式分别为________、________。
(2)W在溶液中的电离方程式为________________________________________________________________________。
(3)25 ℃时,Z溶液的pH>7的原因是__________________________(用离子方程式表示)。
(4)将X、Y、Z各1 mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为____________________________________________。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为____________________________________________。
8.(1)NaOH NH4NO3
(2)NH4NO3===NH +NO
+NO
(3)NO +H2O
+H2O
 HNO2+OH-
HNO2+OH-
(4)c(Na+)>c(NO )>c(NO
)>c(NO )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
(5)NaNO2+NH4NO3===NaNO3+N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
向某FeBr2溶液中,通入1.12 L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3 mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1 mol/L
B.反应后溶液中c(Fe3+)=0.1 mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)A的官能团的名称是________________;C的结构简式是________________;
(2)E是一种具有香味的液体,由B + D→的反应方程式为:
___________________________________,该反应类型是_______________;
(3)G是一种高分子化合物,其链节是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:________________________________,决定F能用于冷冻麻醉应急处理的性质是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com