
在一容积可变的密闭容器中,通入1 mol X和3 mol Y,在一定条件下发生如下反应:X(g)+3Y(g)  2Z(g),到达平衡后,Y的体积分数为a%,然后再向容器中通入2 mol Z,保持在恒温恒压下反应,当达到新的平衡时,Y的体积分数为b%。则a与b的关系是
2Z(g),到达平衡后,Y的体积分数为a%,然后再向容器中通入2 mol Z,保持在恒温恒压下反应,当达到新的平衡时,Y的体积分数为b%。则a与b的关系是
| A.a=b | B.a>b | C.a<b | D.不能确定 |
科目:高中化学 来源: 题型:阅读理解
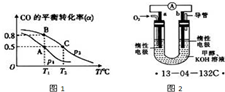 (2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊市高三3月模拟考试(一模)化学试卷(解析版) 题型:填空题
氮及其化合物在工农业生产、生活中有着重要作用。
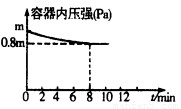
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N2 2NH3? △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为??? mol·L-1·min-1。
2NH3? △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为??? mol·L-1·min-1。
(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容 器中。
①下列各项能说明该反应已达到平衡状态的是?????? (填序号)。
a.容器内N2、H2、NH3的浓度之比为l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比 ??????? (填“变大”“变小”或“不变”)。
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改 变的条件可能是????????? 。
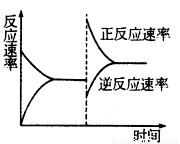
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。??? 氨气能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)??  H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)?  H=-bkJ·mol-1
H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:?????????????? 。
若标准状况下NO与NO2混合气体40.32L被足量氨水完全吸收,产生标准状况下氮气42.56L。该混合气体中NO与NO2的体积之比为??????? 。
查看答案和解析>>
科目:高中化学 来源:2010年山东省潍坊市高三上学期开学摸底考试化学试题 题型:填空题
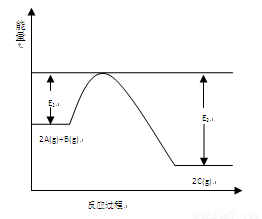
(9分)一定条件下,在一容积可变的密闭容器中,反应: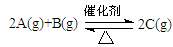 过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
|
时间(min) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
n(A) |
2.00 |
1.90 |
1.82 |
1.76 |
1.64 |
1.54 |
1.50 |
1.50 |
1.50 |
|
n(B) |
1.00 |
0.95 |
0.91 |
0.88 |
0.82 |
0.77 |
0.75 |
0.75 |
0.75 |
|
n(C) |
0 |
0.10 |
0.18 |
0.24 |
0.36 |
0.46 |
0.50 |
0.50 |
0.50 |
回答下列问题:
(1)反应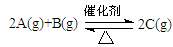 的正反应△H (填“大于”或“小于”)0。
的正反应△H (填“大于”或“小于”)0。
(2)该反应平衡时,下列说法不正确的是
(A)气体的密度不再改变 (B)A的物质的量浓度不变
(C)放出或吸收的热量不再变化 (D)v正(A)=v逆(A)=0
(3)toC时,在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,在一定条件下发生反应,反应中C的物质的量浓度变化情况如下图:
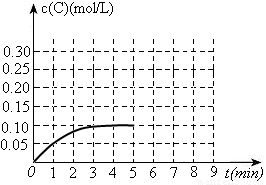
①该温度下,反应: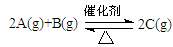 的平衡常数K=
。
的平衡常数K=
。
②反应进行到1分钟时B物质的量为 。
③在第5min时,将容器的体积缩小一半后,若在第8min达到新的平衡时A的总转化率为75%,请在上图中画出第5min到新平衡时C的物质的量浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com