
【题目】硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比![]() 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时,![]() 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
【答案】125 11761 77.78 4.5 ![]() 配料比应增大.
配料比应增大.
【解析】
(1)第一步反应中参加反应甲烷为1m3×80%=0.8m3,根据方程式计算第一步反应生成氢气体积,第二步参加反应甲烷为1m3×20%=0.2m3,根据方程式计算第二步反应生成氢气体积,二者之和为生成氢气总体积,再根据n=![]() 计算;
计算;
(2)根据C元素守恒计算生成二氧化碳的物质的量,再根据K2CO3+CO2=2KHCO3计算需要K2CO3的质量,结合溶解度计算溶液质量;
(3)由方程式可知HNO3、H2O的物质的量之比为1:1,质量之比为63:18,进而计算所得硝酸溶液的质量分数,根据方程式计算生成HNO3、水的质量,可得到硝酸溶液质量,再根据稀释中HNO3质量不变计算稀释后溶液质量,进而计算加入水的质量;
(4)①设蒸馏得到HNO3溶液的质量为xg,蒸馏得到H2SO4溶液的质量为yg,根据溶质质量不变用M1、M2分别表示出x、y,结合M1+M2=x+y进行解答;
②结合①中表达式分析解答,由于H2O流失5%,则此时(x+y)=(M1+M2)×95%。
(1)第一步反应中参加反应甲烷为1m3×80%=0.8m3,由CH4+H2O→CO+3H2可知,第一步反应生成氢气体积为3×0.8m3=2.4m3,第二步参加反应甲烷为1m3×20%=0.2m3,由2CO+CH4+2O2→3CO2+2H2可知,第二步反应生成氢气体积为2×0.2m3=0.4m3,故生成氢气总体积为2.4m3+0.4m3=2.8m3,标况下得到气体物质的量为![]() =125mol;
=125mol;
(2)根据C元素守恒,生成二氧化碳的物质的量为![]() =
=![]() mol,由K2CO3+CO2=2KHCO3可知,需要K2CO3的质量为
mol,由K2CO3+CO2=2KHCO3可知,需要K2CO3的质量为![]() mol×138g/mol,需要饱和K2CO3溶液质量为:
mol×138g/mol,需要饱和K2CO3溶液质量为:![]() mol×138g/mol÷
mol×138g/mol÷![]() =11761g;
=11761g;
(3)由方程式可知HNO3、H2O的物质的量之比为1:1,质量之比为63:18,所得硝酸溶液的质量分数=![]() ×100%=77.78%,
×100%=77.78%,
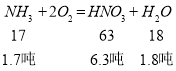
稀释可得50%的硝酸为![]() =12.6吨,故需要加入水的质量为12.6吨﹣6.3吨﹣1.8吨=4.5吨;
=12.6吨,故需要加入水的质量为12.6吨﹣6.3吨﹣1.8吨=4.5吨;
(4)①解:设蒸馏得到HNO3溶液的质量为xg,蒸馏得到H2SO4溶液的质量为yg,则x=![]() ,y=
,y=![]() ,因为M1+M2=x+y,所以
,因为M1+M2=x+y,所以![]() =M1+M2,整理可得
=M1+M2,整理可得![]() =
=![]() ;
;
②所以![]() =(M1+M2)×95%,整理可得
=(M1+M2)×95%,整理可得![]() =
=![]() >
>![]() ,配料比应增大。
,配料比应增大。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】关于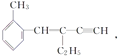 ,下列结论正确的是( )
,下列结论正确的是( )
A. 该有机物分子式为C13H16 B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线 D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
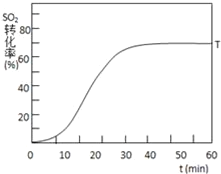
【题目】根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。完成下列填空:
(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)+Q。经2分钟反应达到平衡,测得n(SO3)=0.040mol,则O2的平均反应速率为______
(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有______(选填编号)
a.移出氧气 b.降低温度
c.减小压强 d.再充入0.050molSO2(g)和0.030molO2(g)
(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图,请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图___
(4)黄铁矿在一定条件下煅烧的产物为SO2和Fe3O4
①将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需维持溶液有足够的酸性,其原因是______
②FeS2能将溶液中的Fe3+还原为Fe2+,本身被氧化为SO42﹣。写出有关的离子方程式______。有2mol氧化产物生成时转移的电子数为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E的合成路线如图:
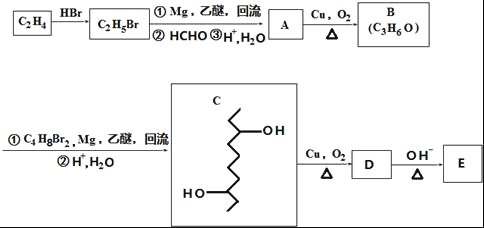
已知:
①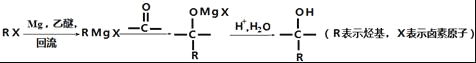
②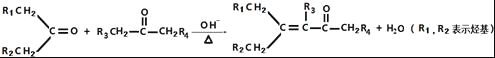
完成下列填空:
(1)B中官能团的名称为_____.C2H4生成C2H5Br的反应类型为____.
(2)C的分子式为_____.
(3)检验C2H5Br分子中含有溴原子的实验方案为____.
(4)E的结构简式为![]() ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
(5)写出一种满足下列条件的有机物的结构简式_____
①分子式只比E少2个氢原子
②与FeCl3发生显色反应
③分子中含有4种不同化学环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家罗伯特莱夫科维茨和布莱恩克比尔卡因“G 蛋白偶联受体研究”而获得2012年诺贝尔化学奖,他们将碘的同位素附着到各种激素上,借助放射学找到一些受体,进一步研究出“G 蛋白偶联受体”发挥的作用和机理,下列有关说法正确的是( )
A.放射性同位素![]() I 原子核内中子数与质子数的差为 78
I 原子核内中子数与质子数的差为 78
B.蛋白质是生物体维持生命活动所需能量的主要来源
C.动物蛋白质和植物蛋白质混合摄入,更能增强蛋白质的营养作用
D.“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种信息材料的添加剂,在相同条件下,A蒸气是同体积氢气质量的88.25倍。在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化。
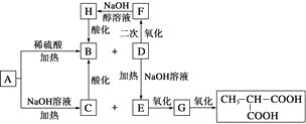
请回答下列问题:
(1)A的分子式为__________。
(2)D分子含有的官能团是________________。
(3)上述转换关系的化学方程式中,属于水解反应的有________个(填数字)。
(4)写出化学方程式:
①A和稀硫酸共热:____________________________________________________;
②E氧化成G:__________________________________________________;
③F与氢氧化钠醇溶液共热:__________________________________________。
(5)与B互为同分异构体的且属于链状酯的物质共有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )

A.通电后,电解质溶液中的电子由阳极移到阴极
B.铜牌与电源正极相连
C.该电解池的阴极反应可表示为Cu2++2e-=Cu
D.当电镀一段时间后,电解质溶液中c(Ag+)保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com