
| A. |  | B. |  | C. |  | D. |  |
分析 先发生的反应是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,然后2Al(OH)3+K2SO4+Ba(OH)2=2KAlO2+BaSO4↓+H2O,即沉淀达最多后溶解一部分,由此分析解答.
解答 解:向一定质量的明矾溶液中滴加Ba(OH)2溶液时,先发生的反应是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,然后2Al(OH)3+K2SO4+Ba(OH)2=2KAlO2+BaSO4↓+H2O,即沉淀达最多后溶解一部分,即图象中沉淀的量先增多,后减少,最后不变,故选C.
点评 本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,侧重于考查学生的分析能力和读图能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3-、Cl- | B. | Cu2+、K+、NO3- | C. | H+、HCO3-、NO3- | D. | Na+、Ba2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
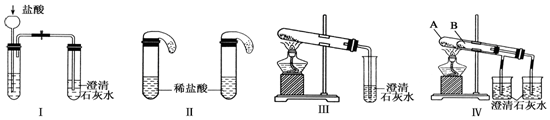
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
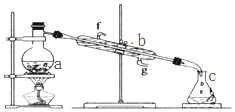 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
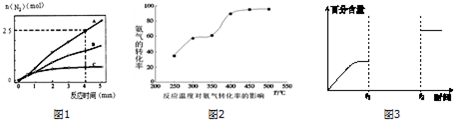
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com