
| 5.6g |
| 12g/mol |
| 14.56L |
| 22.4L/mol |


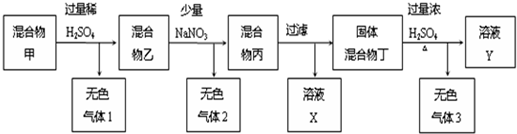
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
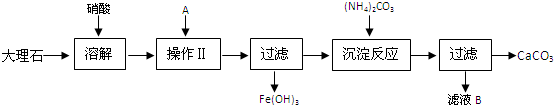
科目:高中化学 来源: 题型:

查看答案和解析>>
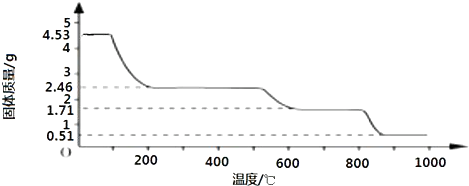
科目:高中化学 来源: 题型:
 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据如图化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据如图化学反应框图填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制取乙烯时,应把无水乙醇与3mol/L的H2SO4混合均匀后迅速升温至170℃ |
| B、分馏操作中,温度计水银球应放置在蒸馏烧瓶支管口附近 |
| C、除去乙酸乙酯中乙酸杂质的方法是加入饱和NaOH溶液,充分振荡、静置后,分液 |
| D、检验溴乙烷中的湨元素的方法是加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
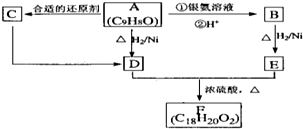
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com