
(8分)①用0.1mol/L的盐酸滴定未知浓度的NaOH溶液 ,下列操作使滴定结果偏低的
是 (填序号)
(1)滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。
(2)滴定前,滴定管尖端有气泡,滴定后气泡消失。
(3)滴定前,用待测液润洗锥形瓶。
(4)读取标准液的刻度时,滴定前平视,滴定后俯视。
(5)滴定后,滴定管尖端挂有液滴未滴入锥形瓶中。
(6)滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。
(7)滴定过程中向锥形瓶内加入少量蒸馏水。
(8)过早估计滴定终点。
②、正确书写电离方程式
H2SO3
Cu(OH)2
NaHCO3
科目:高中化学 来源:2013届河南省濮阳市高二上学期期末考试化学试卷 题型:填空题
(8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是 。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是

A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极'b为阳极;HClO和NaCl
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(8分)、奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是:食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。实验操作步骤:
(1)样品处理:准确称取一定量的固体样品奶粉,移入干燥的凯氏烧瓶中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
(2)NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离状态,游离氨经硼酸吸收。
(3)氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,从消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
A、凯氏烧瓶中溶液转移移到容量瓶中时,未洗涤凯氏烧瓶
B、定容时,俯视刻度线 C、定容时,仰视刻度线 D、移液时,有少量液体溅出
 (3)若称取样品的质量为1.5g,共配制100毫升的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,共用去盐酸的体积为23.0mL,则该样品中N的含量为 。(已知:滴定过程中涉及到的反应方程式:(NH4)2 B4O7 + 2HCl + 5H2O = 2NH4Cl + 4H3BO3)
(3)若称取样品的质量为1.5g,共配制100毫升的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,共用去盐酸的体积为23.0mL,则该样品中N的含量为 。(已知:滴定过程中涉及到的反应方程式:(NH4)2 B4O7 + 2HCl + 5H2O = 2NH4Cl + 4H3BO3)
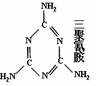
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。其实凯氏定氮法的缺陷并不难弥补,只要先用三氯乙酸处理样品。三氯乙酸能让蛋白质形成沉淀,过滤后,分别测定沉淀和滤液中的氮含量,就可以知道蛋白质的真正含量和冒充蛋白质的氮含量。试求三聚氰胺中氮的含量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是 。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl![]() 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极'b为阳极;HClO和NaCl
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省濮阳市高二上学期期末考试化学试卷 题型:填空题
(8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是 。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极'b为阳极;HClO和NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com