
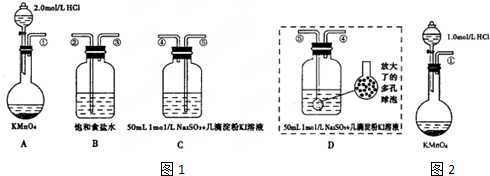
分析 (1)水中有还原性物质能与反应KMnO4;
(2)加热温度低于100℃时,一般采用水浴加热;
(3)KMnO4溶液具有强氧化性用酸式滴定管量取;
(4)选做基准试剂的物质必须满足纯度高、稳定性好,如硫酸亚铁、亚硫酸钠容易被氧化变质的试剂不能作为基准试剂,浓盐酸具有挥发性,也不能做基准试剂;
(5)①滴定终点时最后滴下1滴KMnO4溶液后变色而且半分钟不褪色;
②先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度;
(6)长时间放置后,高锰酸钾溶液浓度变小.
解答 解:(1)由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,所以要除去水中的还原性物质,则将溶液加热并保持微沸1h的目的是将水中还原性物质完全氧化;
故答案为:将水中还原性物质完全氧化;
(2)加热温度低于100℃时,一般采用水浴加热,则要保证在70℃~80℃条件下进行滴定操作,应该水浴加热,用温度计控制水温;
故答案为:水浴加热,用温度计控制水温;
(3)KMnO4溶液具有强氧化性能氧化碱式滴定管中的橡胶管,所以不能用碱式滴定管量取,应该用酸式滴定管量取;
故答案为:酸式滴定管;
(4)A.H2C2O4•2H2O常温下是稳定的结晶水水化物,溶于水后纯度高、稳定性好,可以用作基准试剂,故A正确;
B.FeSO4在空气中不稳定,亚铁离子容易被氧化成铁离子,不宜用作基准试剂,故B错误;
C.浓盐酸不稳定,易挥发,不宜用作基准试剂,故C错误;
D.Na2SO3具有还原性,在空气中容易被氧化成硫酸钠,不宜用作基准试剂,故D错误;
故答案为:A;
(5)①滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟不褪色,说明滴定到达终点;
故答案为:滴下最后一滴KMnO4溶液后,溶液变成紫红色且半分钟内不褪色;
②草酸的物质的量浓度为:$\frac{\frac{Wg}{126g/mol}}{0.5L}$=$\frac{W}{63}$mol/L,根据反应方程式6H++2MnO4-+5H2C2O4•2H2O═2Mn2++10CO2↑+18H2O中草酸和高锰酸钾之间的关系式得,酸性高锰酸钾的物质的量浓度=$\frac{\frac{W}{63}mol/L×0.025L×\frac{2}{5}}{V×1{0}^{-3}L}$=$\frac{W}{6.3V}$mol/L,
故答案为:$\frac{W}{6.3V}$;
(6)在放置过程中,由于空气中还原性物质的作用,使KMnO4溶液的浓度变小了,再去滴定水样中的Fe2+时,需要消耗KMnO4溶液(标准溶液)的体积会增大,导致计算出来的c(Fe2+)值会增大,测定的结果偏高,故答案为:偏高.
点评 本题考查了滴定实验的应用,题目难度中等,明确滴定原理是解答本题的关键,注意基准试剂的选取方法,侧重于考查学生的实验探究能力和计算能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氧化铜溶于稀盐酸中:CuO+2H+=Cu2++2H2O | |
| D. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X>Y | |
| B. | Y单质与Z的最高价氧化物对应的水化物反应可制备氢气 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠 | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H2<△H3<△H1 | C. | △H1=△H2=△H3 | D. | △H1<△H3<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+HCO3-NO3-ClO- | B. | Na+SO32-NH4+Ba2+ | ||
| C. | Ba2+ HS-Cl-SO42- | D. | AlO2-CO32-Cl-Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | NH4+、Mg2+、K+、Al3+ |
| 阴离子 | HCO3-、MnO4-、SO42-、Cl- |
| A. | 肯定没有 Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有 K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 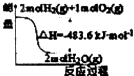 表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ•mol-1 | |
| B. | 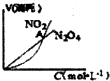 表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 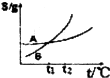 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 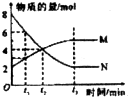 图中在t2时刻正反应速率大于逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com