
某工业废水中可能含有如下几种阴阳离子:
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al + X + OH- =AlO2-+ NH3 + N2 +
该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
【知识点】离子反应,氧化还原反应,溶度积的计算 B1 B3 H5
【答案解析】(1)NO3- SO42-; Ba2+
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)16Al + 9NO3-+ 7OH- =16AlO2- + NH3↑+ 4N2↑+ 2H2O ; NH3 、N2 ; 9.6g
(4)2
解析: (1)少量的无色气体NO生成,气体遇空气立即变为红棕色NO2,说明含有NO3-;加入BaCl2溶液,有白色沉淀生成说明含有SO42-,故不含Ba2+;过量的NaOH溶液,有红褐色沉淀生成说明含有Fe3+;向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成说明含有Al3+,故不含CO32-和SiO32-。(3)从此反应中可以看出X反应完了之后生成了NH3和N2,根据元素守恒得到X应为NO3-;反应前有氢元素,根据元素守恒得到反应后也应该有氢元素,故产物中还有H2O;根据化合价升降相等可以得到此反应。分析本反应中的化合价的变化可以看到氮元素化合价降低即还原产物为NH3 和 N2 ;
根据反应16Al + 9NO3-+ 7OH- =16AlO2- + NH3↑+ 4N2↑+ 2H2O
16mol 9molNO3-
n (Al) 0.2mol
n (Al)=16×0.2/9 mol
故m (Al)= 9.6g
(4)Ksp=1.0×10-38= c(Fe3+)×c3(OH-)
c(Fe3+)=1.0×10-2mol·L-1,故c (OH-)=1.0×10-12 mol·L-1,又KW=1.0×10-14,故c (H+)=1.0×10-2 mol·L-1,pH=2,故将Fe3+转换为Fe(OH)3沉调节溶液pH至少大于2。
【思路点拨】本题考查了离子反应和离子共存的应用,氧化还原反应的应用,溶度积的计算,涉及到的知识内容较多,综合性较强。


科目:高中化学 来源: 题型:
关于下列各图像的说法中正确的是
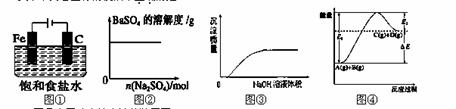
A.图①表示防止铁腐蚀的装置图
B.图②表示向BaSO4饱和溶液中加入硫酸钠
C.图③表示将NaOH溶液滴入Ba(HCO3)2溶液中
D.图④表示反应物的总键能大于生成物的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
① A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液 B.稀硫酸
C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。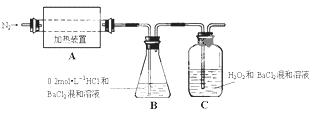
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2+ + O2 + (4+2x) H2O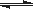 2Fe2O3•xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
2Fe2O3•xH2O + 8H+,硫酸亚铁铵溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,2.24L三氯甲烷含有分子数目为0.1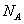
B.1 mol FeI2与足量氯气反应转移的电子数为2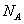
C.1 molCH3COONa 和少量CH3COOH溶于水所得中性溶液中,CH3COO-数目为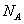
D.标准状况下,22.4L的乙烯中含有的共用电子对数为12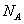
查看答案和解析>>
科目:高中化学 来源: 题型:
常见元素A、B、M组成的四种物质发生反应:甲+乙 丙+丁,其中甲由A和M组成,乙由B和M组成,丙只含M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为 ;生成标准状况下5.6L丙转移移电子数为 ;常温下丁溶液pH 7,用离子方程式解释 。
(2)若丁为能使品红褪色的无色气体,丙为常见紫红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。则:
①A在周期表中位置为
②将丁通至FeCl3溶液中的现象为
离子反应方程式为
③正确书写上述生成丙的化学方程式
④向MCl2的溶液中通入丁,可观察到白色的MC1沉淀,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A. NaHSO4 溶液与Ba(OH)2溶液反应至中性:
2H++SO42-+Ba2++2OH-=BaSO4 +2H2O
+2H2O
B. 向FeCl2溶液中通入氯气:Fe2++ Cl2= Fe3++2Cl-
C. 向Ca(ClO)2溶液中通入过量的SO2:ClO-+ SO2+ H2O= HClO+ HSO3-
D. FeSO4酸性溶液中加H2O2: 2Fe2++ H2O2= 2Fe3++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
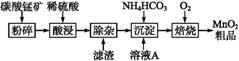
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH) |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是 。
(2)酸浸后的溶液中含有Mn2+、S,另含有少量Fe2+、Fe3+、Al3+、Cu2+、 Pb2+等,其除杂过程如下:
Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去 。
(3)从溶液A中回收的主要物质是 ,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 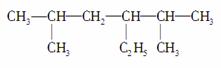 的名称是
的名称是
____________________________。
(2)2,4,6三甲基5乙基辛烷的分子中共有______个甲基原子团。
(3)分子中有6个甲基而一溴代物只有1种的烷烃的分子式是__________,其结构简式是__________________,名称是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com