
| A. | v(A)=0.5mol•L-1•min-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=0.1mol•L-1•s-1 | D. | v(D)=0.4mol•L-1•min-1 |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率与其化学计量数的比值越大,表示的反应速率越快,注意保持单位一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率与其化学计量数的比值越大,表示的反应速率越快.
A.$\frac{v(A)}{1}$=0.25mol/(L.min);
B.v(B)=0.3mol•L-1•s-1=18mol/(L.min),$\frac{v(B)}{3}$=6mol/(L.min);
C.v(C)=0.1mol•L-1•s-1=6mol/(L.min),$\frac{v(C)}{2}$=3mol/(L.min),
D.$\frac{v(D)}{2}$=0.2mol/(L.min),
故反应速率v(B)>v(C)>v(A)>v(D),
故选:B.
点评 本题考查化学反应速率快慢比较,难度不大,注意对速率规律的理解与灵活应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 元素的第一电离能是第3周期所有元素中最小的 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
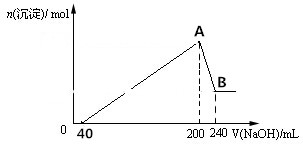
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌电极发生还原反应:铜电极发生氧化反应 | |
| B. | 铜电极做正极发生的电极反应为:2H++2e-═H2↑ | |
| C. | 当有13g Zn溶解时,电路中就有0.5mol电子通过 | |
| D. | 电子从锌电极通过电流表流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 12g NaHSO4固体中阴离子所带负电荷数为0.02 NA | |
| C. | 1 mol OD-含有的质子、中子、电子数均为9NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
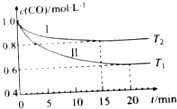 为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.
为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 过量Ba(OH)2溶液与少量的NaHCO3溶液混合Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| C. | 石英溶于NaOH溶液:Si4++2O2-+2OH-=SiO32-+H2O | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com