
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
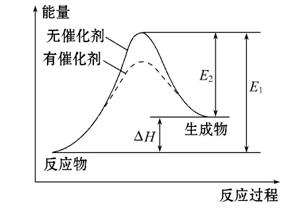
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D四种短周期非金属元素,原子最外层电子数之和为19。在化合物中,这四种元素常见化合价均不止一种,但有一种相同的化合价。其部分性质如下:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正价或最低负价 | +6 | -4 | +4 | -3 |
下列说法错误的是( )
A.四种元素在化合物中具有一种相同的化合价,即+4
B.高温下B可从C的氧化物中置换出C的单质
C.四种元素的最高价含氧酸均为强酸
D.只由非金属元素组成且含D元素的化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
将盛有NH4HCO3粉末的小烧杯放入盛 有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是 ( )。
A.2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
B.2SO2(g)+O2(g)  SO3(g) ΔH=-98.3 kJ·mol-1
SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+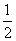 O2(g)
O2(g)  SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+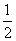 O2(g)
O2(g)  SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物是重要的非金属材料。由石英砂制取高纯硅的主要化学反应有:
①粗硅的制取:SiO2+2C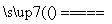 Si(粗)+2CO
Si(粗)+2CO
②粗硅中Si与Cl2反应:Si(s)+2Cl2(g)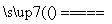 SiCl4(g) ΔH=-akJ/mol
SiCl4(g) ΔH=-akJ/mol
③粗硅的提纯反应:SiCl4(g)+2H2(g)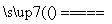 Si(s)+4HCl(g)'ΔH
Si(s)+4HCl(g)'ΔH
请回答下列问题:
(1)上述三个反应都属于________(填反应类型)。
(2)已知1mol Si固体中有2mol Si-Si键,1mol O2中有1mol O=O键,1mol SiO2固体中有4mol Si-O键。某些化学键数据如下:
| 化学键 | Si-O | Cl-Cl | H-H | H-Cl | Si-Si | O=O |
| 断键所需能量/(kJ·mol-1) | 460 | 243 | 436 | 431 | 176 | 498 |
根 据化学键数
据化学键数 据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
(3)可由反应②和另一个反应______________________________ (填化学方程式)通过盖斯定律计算获得反应③的反应热,若该反应每生成1mol化合物的反应热ΔH=-bkJ/mol,则反应③的反应热ΔH=________kJ/mol(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )

|
| A. | 若甲是AlCl3溶液,则丁可能是NaOH溶液 |
|
| B. | 若甲是Fe,则丁可能是Cl2 |
|
| C. | 若丁是CO2,则甲可能为Mg |
|
| D. | 若丁是O2,则乙、丙的相对分子质量可能相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组利用丙酮的溴代反应(CH3COCH3+B r2
r2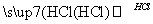 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
| 实验 | 初始浓度c/mol/L | 溴颜色消失所需时间t/s | ||
| 序号 | CH3COCH3 | HCl | Br2 | |
| ① ② ③ ④ | 0.80 1.60
0.80 | 0.20 0.20 0.40 0.20 | 0.0010 0.0010 0.0010 0.0020 | 290 145
580 |
分析实验数据所得出的结论不正确的是 ( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com