
| A、该反应的氧化剂为CuI,氧化产物为Cu |
| B、产物Cu2HgI4中,Cu元素的化合价为+2 |
| C、当有2mol CuI参与反应时,转移电子为1mol |
| D、由Cu2+与I直接反应制得CuI的离子方程式为Cu2++I-=CuI |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1mol?L-1 Na2CO3溶液中,含CO32-数目小于NA |
| B、标准状况下,11.2L O2和O3组成的混合气体含有原子数为NA |
| C、14 g聚乙烯与聚丙烯的混合物,含C-H键的数目为2NA |
| D、常温常压下,22.4L CO2与足量Na2O2反应转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:| 元素 | A | B | C | D | E |
| 相关 信息 |
最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
查看答案和解析>>
科目:高中化学 来源: 题型:
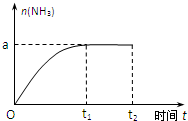 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )| A、加NaOH,HA电离平衡常数增大 |
| B、通入HCl,溶液中阴离子浓度之和减小 |
| C、溶液中水的电离程度a>b>c |
| D、b点溶液中,c(HA)<c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
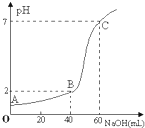 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述正确的是( )| A、所用HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1 |
| B、在B点,溶液中离子浓度关系为:c(Cl-)>c(Na+)>c(H+)>c(OH-) |
| C、A.B.C三点水的电离程度大小依次为:A>B>C |
| D、滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量氯气通入溴化亚铁溶液中:2Cl2+2Fe2++2Br-═4Cl-+2Fe3++Br2 |
B、向苯酚溶液中滴加Na2CO3溶液: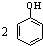 +CO32-→ +CO32-→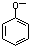 +CO2↑+H2O +CO2↑+H2O |
| C、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
| D、用过量的冷氨水吸收SO2:SO2+2NH3?H2O═SO32-+2NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧 | 火焰呈黄色 | 待测液不含钾元素 |
| B | AgBr沉淀中滴入KCl溶液 | 有白色沉淀出现 | AgCl比AgBr更难溶 |
| C | 铁丝插入稀硝酸中 | 有无色气体产生 | 生成氢气 |
| D | 向NaCN溶液中滴加无色酚酞试液 | 溶液变红 | HCN是弱电解质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com